ACUERDO por el que se modifica el diverso por el que el Consejo de Salubridad General declara la obligatoriedad de los esquemas de tratamiento antirretroviral, así como los procesos señalados en la Guía de Manejo Antirretroviral de las Personas con VIH, publicado el 14 de noviembre de 2012. (Continúa en la Tercera Sección).
Al margen un sello con el Escudo Nacional, que dice: Estados Unidos Mexicanos.- Consejo de Salubridad General.
El Consejo de Salubridad General, con fundamento en los artículos 4o, párrafo cuarto y 73, fracción XVI, Bases 1a y 3a de la Constitución Política de los Estados Unidos Mexicanos; 3o, fracciones II, IV, XV y XV Bis, 4o, fracción II y 25 de la Ley General de Salud, así como 1, 9, fracción II y 10, fracción VIII del Reglamento Interior del Consejo de Salubridad General, y
CONSIDERANDO
Que el artículo 4o, párrafo cuarto de la Constitución Política de los Estados Unidos Mexicanos reconoce el derecho humano que toda persona tiene a la protección de la salud;
Que en términos de lo dispuesto en los artículos 73, fracción XVI, Bases 1a y 3a de la Constitución Política de los Estados Unidos Mexicanos y 4o, fracción II de la Ley General de Salud, el Consejo de Salubridad General tiene el carácter de autoridad sanitaria y sus disposiciones generales serán obligatorias en el país, debiendo ser obedecidas por toda autoridad administrativa;
Que el Consejo de Salubridad General, con base en las atribuciones que le confieren la Constitución Política de los Estados Unidos Mexicanos, la Ley General de Salud y su Reglamento Interior, participa en el ámbito de su competencia, en la consolidación y funcionamiento del Sistema Nacional de Salud y en el establecimiento de la política nacional en materia de salud;
Que en términos de las fracciones II, IV, XV y XV Bis del artículo 3o de la Ley General de Salud, son materias de salubridad general, la atención médica, preferentemente en beneficio de grupos vulnerables; la atención materno-infantil; la prevención y el control de enfermedades transmisibles, así como el Programa Nacional de Prevención, Atención y Control del VIH/SIDA e Infecciones de Transmisión Sexual;
Que de conformidad con el artículo 25 de la Ley General de Salud, el Sistema Nacional de Salud garantizará la extensión cuantitativa y cualitativa de los servicios de salud, preferentemente a los grupos vulnerables;
Que el Consejo de Salubridad General tiene, conforme a la fracción II del artículo 9 de su Reglamento Interior, la atribución de aprobar los acuerdos necesarios y demás disposiciones generales de observancia obligatoria en el país en materia de salubridad general, dentro del ámbito de su competencia;
Que acorde con lo anterior, el 14 de noviembre de 2012 se publicó en el Diario Oficial de la Federación el "Acuerdo por el que el Consejo de Salubridad General declara la obligatoriedad de los esquemas de tratamiento antirretroviral, así como los procesos señalados en la Guía de Manejo Antirretroviral de las Personas con VIH";
Que con la finalidad de contribuir a obtener un mayor grado de sobrevida a las personas que viven con VIH/SIDA, el grupo de trabajo interinstitucional coordinado por el Consejo Nacional para la Prevención y Control del VIH/SIDA, realizó la actualización de la referida Guía de Manejo Antirretroviral de las Personas con VIH, y
Que en la Segunda Sesión Ordinaria, celebrada el día 13 de noviembre de 2018, el Pleno del Consejo de Salubridad General, en aras de contribuir a mejorar las condiciones de salud y calidad de la atención a las personas afectadas por el VIH/SIDA y de mejorar los programas de prevención y control de este síndrome, tuvo a bien expedir el siguiente
ACUERDO POR EL QUE SE MODIFICA EL DIVERSO POR EL QUE EL CONSEJO DE SALUBRIDAD
GENERAL DECLARA LA OBLIGATORIEDAD DE LOS ESQUEMAS DE TRATAMIENTO
ANTIRRETROVIRAL, ASÍ COMO LOS PROCESOS SEÑALADOS EN LA GUÍA DE MANEJO
ANTIRRETROVIRAL DE LAS PERSONAS CON VIH, PUBLICADO EN EL DIARIO OFICIAL DE LA
FEDERACIÓN EL 14 DE NOVIEMBRE DE 2012
GENERAL DECLARA LA OBLIGATORIEDAD DE LOS ESQUEMAS DE TRATAMIENTO
ANTIRRETROVIRAL, ASÍ COMO LOS PROCESOS SEÑALADOS EN LA GUÍA DE MANEJO
ANTIRRETROVIRAL DE LAS PERSONAS CON VIH, PUBLICADO EN EL DIARIO OFICIAL DE LA
FEDERACIÓN EL 14 DE NOVIEMBRE DE 2012
ARTÍCULO ÚNICO. Se modifica el Anexo Único "Guía de Manejo Antirretroviral de las Personas con VIH" del "Acuerdo por el que el Consejo de Salubridad General declara la obligatoriedad de los esquemas de tratamiento antirretroviral, así como los procesos señalados en la Guía de Manejo Antirretroviral de las Personas con VIH", publicado en el Diario Oficial de la Federación el 14 de noviembre de 2012, para quedar en los términos del presente Acuerdo.
TRANSITORIO
ÚNICO. El presente Acuerdo entrará en vigor al día siguiente de su publicación en el Diario Oficial de la Federación.
Ciudad de México, a 13 de noviembre de 2018.- El Secretario de Salud y Presidente del Consejo de Salubridad General, José Ramón Narro Robles.- Rúbrica.- El Secretario del Consejo de Salubridad General,
Jesús Ancer Rodríguez.- Rúbrica.
ANEXO ÚNICO
Guía de Manejo Antirretroviral de las Personas con VIH
Presentación
El tratamiento antirretroviral ha transformado a la infección por el VIH y al sida, de una enfermedad que se consideraba como mortal a una enfermedad crónica que les permite a las personas en tratamiento incorporarse a una vida productiva. Sin embargo, es necesario un manejo integral que les permita a estas personas llevar una buena calidad de vida.
Antes de la llegada a México de los tratamientos antirretrovirales, la supervivencia de las y los pacientes diagnosticados con VIH era de un año. A partir de 1996, el acceso progresivo a un nuevo grupo de antirretrovirales, conocidos como inhibidores de proteasa (IP), cambió radicalmente el pronóstico de las personas con VIH. Se demostró que los IP, combinados con los medicamentos existentes (los inhibidores de la transcriptasa, en lo que se denominó tratamiento antirretroviral de alta actividad o TARAA), lograban retrasar el daño del sistema inmunológico y mejorar sustancialmente la calidad de vida de las personas con VIH.
Por ello, desde 1998, la Secretaría de Salud estableció un programa de acceso al tratamiento antirretroviral para las personas que viven VIH sin seguridad social. Cabe destacar que para el año 2003 se logró alcanzar el acceso universal del tratamiento antirretroviral, planteando a partir de entonces el reto de mantenerlo como una política sustentable y permanente.
En 2008 se creó la Comisión Negociadora de Precios de Medicamentos y otros Insumos para el Sector Salud, la cual ha desarrollado negociaciones con la industria farmacéutica para disminuir el costo de los medicamentos antirretrovirales de patente, permitiendo que el programa sea sustentable.
Actualmente se dispone de 20 fármacos antirretrovirales que se utilizan en el tratamiento de personas que viven con VIH o sida en 32 presentaciones, incluyendo presentaciones coformuladas que se proveen a la población adulta y pediátrica.
Con el objetivo de mejorar la atención e incrementar la supervivencia de las personas con VIH, mediante una prescripción más adecuada, el Consejo Nacional para la Prevención y el Control del VIH y el sida (Conasida) acordó convocar a los coordinadores de la elaboración de la Guía de manejo antirretroviral de las personas con VIH, para adicionar, modificar o eliminar recomendaciones del tratamiento antirretroviral, toda vez que existan situaciones que generen un beneficio en la salud de las personas con VIH y un impacto favorable en la salud pública.
Esto permite disponer de un documento oficial nacional para quienes toman decisiones y para el personal que brinda atención en todas las instituciones de salud públicas.
La presente Guía fue elaborada por un grupo de trabajo de tratamiento antirretroviral que incluyó personal experto en la atención de población infantil y adulta, el cual fue designado por titulares de las vocalías del Conasida, y que tiene representación oficial de todas las instituciones del sector salud que atienden a personas con VIH.
Las recomendaciones vertidas sobre el tratamiento antirretroviral se elaboraron con el consenso de las y los autores que participaron en su elaboración siguiendo los principios de la Medicina Basada en Evidencia. Asimismo, se consideraron las opiniones de médicas y médicos líderes de opinión, quienes forman parte de otros grupos dedicados a la investigación y el manejo de personas que viven con VIH, tanto en forma directa como electrónica y de acuerdo con la evidencia de clínicas internacionales.
Las recomendaciones ofrecidas han sido ponderadas de acuerdo con el peso de las mismas y a la solidez de la evidencia existente, de acuerdo con la escala de graduación para recomendaciones propuesta por el Departamento de Salud y Servicios Sociales de los Estados Unidos (HHS por sus siglas en inglés), en el documento Directrices para el uso de agentes antirretrovirales en población adulta y adolescente infectada por el VIH-1 de 2014.
La Norma Oficial Mexicana NOM-010-SSA2-2019 Para la prevención y el control de la Infección por Virus de la Inmunodeficiencia Humana vigente señala en el numeral 6.10 de atención y tratamiento de pacientes con VIH/sida que el tratamiento de las personas con VIH, debe ser conforme a esta Guía. Asimismo, el Consejo de Salubridad General, acordó la aplicación de esta Guía de forma obligatoria para todas las
instituciones del sector salud. Su obligatoriedad es relevante en el mejor interés de las personas con VIH.
Introducción
La Medicina Basada en la Evidencia consiste en la integración de la experiencia clínica individual de las y los profesionales de la salud con la mejor evidencia proveniente de la investigación científica, una vez asegurada la revisión crítica y exhaustiva de ésta. Esta Guía pretende ofrecer la mejor información científica disponible para que ésta sea parte importante del sustento de las decisiones cotidianas en la práctica clínica.
Para la elaboración de este documento se consultaron las evidencias científicas sobre el tema y las revisiones sistemáticas de alta calidad con el fin de sustentar la recomendación o la descalificación de las diversas opciones de intervención médica. No se pretende describir un protocolo rígido de atención donde todos los puntos deben estar incorporados, sino mostrar una referencia flexible, de acuerdo con la individualidad de cada paciente.
Objetivo General
El propósito central en el cuidado de las personas que viven con VIH es proporcionarles atención integral a través de un conjunto diverso de profesionales que tienen como objetivo común ofrecer dicha atención integral, con igual valor de las aportaciones y con diferencias en el tipo de información e intervención que hay que realizar, tomando en cuenta los aspectos físicos, psicológicos, sociales y éticos.
Esta Guía proporciona recomendaciones para favorecer la toma de decisiones médicas en personas adultas, niñas y niños con problemas específicos relacionados con el VIH, como una herramienta que contribuya a mejorar la calidad de la atención, disminuir la frecuencia de tratamientos innecesarios, inefectivos o dañinos y minimizar la probabilidad de eventos adversos. La clasificación de las recomendaciones(1) utilizada en esta Guía se describe a continuación:
| Fuerza de la recomendación | Calidad de la evidencia para la recomendación |
| A: Recomendación fuerte para el enunciado | I: Uno o más ensayos clínicos aleatorizados con resultados clínicos o de laboratorio adecuadamente validados |
| B: Recomendación moderada para el enunciado | II: Uno o más ensayos clínicos no aleatorizados, con diseño adecuado o estudios de cohorte observacionales con desenlaces clínicos a largo plazo |
| C: Recomendación opcional para el enunciado | III: Opinión de personal experto |
Capítulo 1
1. Evaluación inicial y subsecuente de las personas que viven con VIH
1.1. Evaluación de las personas adultas que viven con VIH
Tabla 1. Evaluación de las personas que viven con VIH en la visita inicial y visitas sucesivas
| Evaluación | 1era consulta | Antes de inicio ARV | Frecuencia de evaluación | Comentario | ||
| con ARV | sin ARV | |||||
| Historia clínica: Antecedentes | ||||||
| Familiares | Historia familiar (ECV, DM, DLP, ERC) | P | P | | Evento CV prematuro: IAM en un familiar de 1ergrado (H<55 años y M< 65 años). | |
| Antecedentes médicos | Comorbilidades | Importante para la elección del TAR. Vigilancia más estrecha por mayor riesgo de desarrollo de dichas patologías. Detectar interacciones medicamentosas y evaluar una mejor opción de tratamiento. | ||||
| Previas | P | P | Cada visita | Anual | ||
| Actuales | P | P | ||||
| Fármacos concomitantes | P | P | ||||
| Hábitos: consumo alcohol, tabaco, dieta, ejercicio aeróbico. | P | P | Cada 6 o 12 meses | Detectar factores de riesgo. Fomentar cambio de estilo de vida. | ||
| Vacunas | P | | | Ofrecer vacunas de acuerdo con edad e infección a prevenir. | ||
| Salud sexual y reproductiva | Antecedentes Sexuales | P | P | | Inicio vida sexual, número de parejas, orientación sexual, tipo de relaciones sexuales. | |
| Sexo protegido | P | P | Cada visita | Se recomienda proveer servicios de notificación asistida en caso de ser necesario. Ver: Guía para la detección del VIH. | ||
| Estado serológico de la pareja actual | P | P | ||||
| Planificación familiar | P | P | | Consejería sobre métodos de reproducción, consejería sobre anticoncepción. Ver: Algoritmo 1 y Tabla 49 | ||
| Historia clínica: Exploración física | ||||||
| Completa | Signos vitales | P | P | Cada visita | Realizar examen del fondo de ojo en todas las personas (basal) y c/3 meses durante un año en pacientes con CD4 <200 cel./ml que inician TAR. | |
| Peso, talla, e IMC | P | P | Anual y/o siempre que la situación clínica del paciente lo requiera. | |||
| Piel | P | P | ||||
| Orofaringe | P | P | ||||
| Cardiopulmonar | P | P | ||||
| Abdomen | P | P | ||||
| Ganglios linfáticos | P | P | ||||
| Musculo-esquelético | P | P | ||||
| Neurológica (evaluación neuro-cognitiva) | P | P | ||||
| Evaluación psiquiátrica e identificación de violencia intrafamiliar. | P | P | ||||
| Anogenital | P | P | ||||
| Infección por VIH | ||||||
| CV-VIH en plasma | P | P | | Ver Tabla 2 | ||
| Genotipo viral Tropismo R5 | | | | Realizar en pacientes con falla al control viral y/o a múltiples esquemas. | ||
| Inmunología | Cuenta absoluta y porcentual de células T CD4 | P | P | | | Ver Tabla 2 |
| Coinfecciones | ||||||
| ITS | Serología para sífilis | P | | Anual | Considerar una mayor frecuencia si existe riesgo o como se indica para valorar respuesta a tratamiento. | |
| Escrutinio de ITS | P | | Considerar una mayor frecuencia si existe riesgo. | |||
| Hepatitis viral | Serología para VHB | P | | Repetir anualmente en caso de existir riesgo de infección. Vacuna contra VHB en caso de no tener inmunidad. | ||
| Serología para VHC | P | | ||||
| Tuberculosis | Radiografía de tórax | P | | | Realizar siempre que la situación clínica de la persona lo requiera | |
| Baciloscopías | P | | | |||
| PPD o IGRA | P | | | Repetir en caso de existir exposición | ||
| VPH | Citología cervicouterina | P | | 6 o 12 meses | Detección de cáncer de cuello uterino con citología cervical cada 6 meses en el año inmediato al diagnóstico y, en caso de tener resultado negativo, cada año. | |
| Citología anal | P | | | Realizar siempre que la situación clínica de la persona lo requiera | ||
| Otros | IgG anti Toxoplasma | P | | | Profilaxis de infecciones oportunistas (Tabla IIIB) | |
| Estudios de laboratorio y gabinete | ||||||
| Hematología | Biometría hemática | P | P | 6 o12 meses | Anual | |
| Lípidos | TG, CT, c-HDL, c-LDL | P | P | Anual | | |
| Glucosa | Glucosa plasmática | P | P | 6 o12 meses | | |
| Estudios de laboratorio y gabinete | ||||||
| Función hepática | AST/ALT, ALP, Bilirrubina | P | P | 6 o12 meses | Anual | |
| Función renal | BUN, creatinina, sodio, potasio, cloro, fósforo séricos | P | P | 6 o12 meses | Realizar el control más frecuente en caso de existir factores de riesgo de ERC. | |
| Calcular TFG (MDRD o Cockroft-Gault) | P | P | 6 o12 meses | |||
| Examen general de orina | P | P | 6 o12 meses | |||
| Evaluación cardiaca | Riesgo cardiovascular (escala Framingham) | P | P | Anual | Realizar en todos los hombres >40 años y mujeres >50 años sin enfermedad cardiovascular. | |
| Evaluación ósea | Perfil óseo (Ca, P, y fosfatasa alcalina) | P | P | 6 o12 meses | | |
| Riesgo de fracturas (FRAX Herramienta de evaluación de riesgo de fractura de OMS) | P | P | 2 años | |||
| Antes de realizar un procedimiento al paciente menor se recomienda solicitar el consentimiento de la persona responsable de su cuidado. | ||||||
Tabla 2. Monitoreo de las personas que viven con VIH en la visita inicial y visitas sucesivas
| Escenario clínico | Carga viral en plasma | Conteo de linfocitos CD4a |
| Antes de iniciar TAR | Al inicio de la atención (AIII). Si el inicio de TAR se difiere por más de 6 meses, repetir antes de iniciar TAR (CIII). | Al diagnóstico y al inicio de la atención (AI). Si TAR es diferido, cada 4 a 6 meses (AIII). |
| Después de iniciar TAR | A los 2 meses después del inicio de TAR; posteriormente, a los 6 y 10 meses (CIII) del inicio de TAR, y después cada 4 a 6 meses durante los primeros dos años (AIII) | 2 a 6 meses después del inicio de TAR (AIII) y después cada 4 a 6 meses en los primeros dos años (BIII) |
| Después de modificar TAR por toxicidades, o simplificación, en pacientes con CV indetectable o por falla virológica | A los 2 meses después del inicio de TAR; posteriormente, a los 6 y 10 meses (CIII) del inicio de TAR, y después cada 4 a 6 meses durante los primeros dos años (AIII) | 2 a 6 meses después del inicio de TAR (AIII) y después cada 4 a 6 meses en los primeros dos años.b (BIII) |
| Pacientes con < 300/CD4 | Cada 4 a 6 meses (AIII) | Cada 4 a 6 meses (AI) |
| Después de 2 años en TAR, carga viral consistentemente indetectable y CD4 =300) | Se puede extender a cada 6 meses (AIII) | Cada 12 meses (BII) |
| En TAR, con cargas virales detectables | Repetir CV lo antes posible, dentro de las 4 semanas. | Revisar tabla de falla virológica |
| Deterioro en el estatus clínico | Realizar lo más pronto posible y posteriormente cada 4 a 6 meses | Realizar CD4 y repetir acorde a lo clínicamente indicado |
| Inicio de interferón y/o terapia inmunosupresora | Realizar cada 4 a 6 meses | Realizar CD4 y repetir acorde a lo clínicamente indicado |
| a. El monitoreo de otras subpoblaciones linfocitarias (tal como las células T CD8) no ha probado tener una utilidad clínica y no se recomienda su medición rutinaria. b. La cuenta absoluta y porcentual de linfocitos CD4 debe medirse cada cuatro o seis meses tras el inicio de TAR, particularmente en pacientes con cuentas menores a las 300 células/mm3, para determinar la necesidad de inicio o suspensión de la profilaxis primaria (o secundaria) de infecciones oportunistas. | ||
Para mayor información sobre la atención de personas lésbico, gay, bisexual, transexual, travesti, transgénero e intersexual revisar el Protocolo para el acceso sin discriminación a la prestación de servicios de atención médica de las personas lésbico, gay, bisexual, transexual, travesti, transgénero e intersexual y guías de atención específicas de la Secretaría de Salud, disponible en:
www.gob.mx/cms/uploads/attachment/file/233408/210617Protocolo_Comunidad_LGBTTI_DT_Versi_n_III_17_3.pdf
1.2. Evaluación de niños, niñas y adolescentes que viven con VIH
Tabla 3. Evaluación de niños, niñas y adolescentes que viven con VIH en la visita inicial y visitas
sucesivas
sucesivas
| Evaluación | Evaluación inicial | Frecuencia de evaluación subsecuente | Comentarios | ||
| Historia clínica: antecedentes | |||||
| Transmisión vertical | Maternos | P | | - Momento del diagnóstico del VIH - Virgen a ARV/resistencia - Tratamiento a ARV, momento de inicio, apego a medicamentos - Manifestaciones clínicas - CV-VIH, basal y final - Tipo de parto - Tiempo de ruptura de membranas - Profilaxis intraparto | |
| Recién nacido | P | - Profilaxis ARV - Supresión de lactancia materna, edad a la supresión - Lactancia mixta, tiempo | |||
| Cualquier tipo de transmisión de VIH | Comorbilidades en padres y/o cuidador primario | P | | |
| Vacunación | P | Cada visita | Actualizar cartilla de vacunación (Tabla IV-A) | |
| Uso de medicamentos diferentes a ARV | P | Cada año* | Importante para la elección del TAR, momento de inicio y en cada cambio de ARV, posibles interacciones * En inmunosupresión grave revisar cada 3-4 meses | |
| Entorno familiar | P | | | |
| Revelación del diagnóstico | P | | Recomendado a partir de los 8 años | |
| Evaluación del adolescente | ||||
| Desarrollo puberal | P | Cada 6 meses | Evaluar escala de Tanner a partir de los 8 años hasta completar desarrollo (aprox. 15 años) | |
| Salud sexual y reproductiva | Inicio de vida sexual | P | Cada visita | Evaluar ITS, educación sexual Consejería sobre métodos de reproducción, consejería sobre anticoncepción. Ver: Algoritmo 1 y Tabla 49 Se recomienda proveer servicios de notificación asistida en caso de ser necesario. Ver: Guía para la detección del VIH. |
| Tipo de relaciones sexuales | ||||
| Número de parejas sexuales | ||||
| Estado serológico de la pareja actual | ||||
| Orientación sexual | ||||
| Uso de condón | ||||
| Uso y tipo de anticonceptivo | ||||
| Consumo de sustancias psicoactivas | P | Cada visita | Tipo de sustancias, patrón y tiempo. Solicitar apoyo a establecimientos especializados en adicciones. | |
| Desarrollo psicomotor y salud de adolescentes | P | Cada visita | Consultar NOM -031-SSA2-1999, NOM-047-SSA-2014; www.censia.salud.gob.mx Desarrollo Infantil |
| Conocimiento del diagnóstico de VIH y aceptación | P | Cada visita | Apoyo con psicología |
| Historia clínica: exploración física | |||
| Signos vitales | P | Cada visita | |
| Somatometría, centiles pondoestaturales | P | Cada visita | De acuerdo a la evaluación del niño sano (CeNSIA) |
| Exploración física completa, especificar salud bucal, ganglios linfáticos, visceromegalias, región anogenital* | P | Cada visita | *En adolescentes al detectar conductas de riesgo Consejería sobre métodos de reproducción, consejería sobre anticoncepción. Ver:Algoritmo 1 y Tabla 49 |
| Fondo de ojo | P | Cada 6 meses* | *En personas con estadio 3, si es posible apoyo por oftalmólogo |
| Antirretrovirales | |||
| Aceptación del tratamiento por el paciente y cuidador primario | P | | Evaluar en cada cambio de TAR |
| Apego | P | Cada visita* | Explicar la importancia del apego, Consejería. * Valorar el incremento en número de visitas de acuerdo a evaluación de apego |
| Revisión de dosis de ARV | | Cada visita | |
| Evaluación por especialistas | |||
| Neurología, Cardiología | P | | Revaloración en caso de requerirse |
| Odontología | P | Cada 12 meses | Se requerirá evaluación más seguido en caso de manejo bucodental |
| Psicología | P | Cada visita | El incremento de la frecuencia de las visitas dependerá de la valoración por psicología |
| Nutrición | P | Cada 6 meses | |
| Ginecología | P | | En mujeres cisgénero y hombres transgénero adolescentes al inicio o si hay sospecha de VSA |
Tabla 4. Monitoreo de laboratorio en niños, niñas y adolescentes que viven con VIH
| Laboratorio/ gabinete | Momento de la evaluación | ||||||
| Inicio de TAR | Después del inicio del TAR | Cambio de TAR | Comentario | ||||
| 1-2 s | 3-4 s | c/ 3-4 meses | c/6-12 meses | ||||
| CV | X | | X | X | | X | |
| Linfocitos CD4+, cuenta total o porcentaje | X | | | X | X* | X | *Pacientes con edad> 6 años, con CV indetectable por al menos 2 años, estadio clínico estable, cuenta de CD4+ por encima del riesgo de IO y buen apego, realizar c/6 a 9 meses. |
| Genotipo viral | X | | | | | X* | *Falla a tratamiento que condicione cambio. |
| Biometría hemática completa | X | | X* | X | X** | X | *Si recibe ZDV realizarla a las 2-3 semanas del inicio del medicamento. **Pacientes estables/asintomáticos, con CV indetectable, sin alteraciones en la BH. |
| Cr, BUN*, depuración de Cr (Schwartz), AST/ALT, bilirrubinas | X | | X | X | X** | X | *Se recomienda realizar BUN en pacientes que reciben TDF. **Pacientes estables/asintomáticos, sin alteraciones en la química sanguínea. |
| Perfil de lípidos | X | | | | c/12 meses* | | Recomendar 12 h de ayuno antes de la toma. *Más frecuente en caso de alteraciones. |
| Examen general de orina o tira reactiva | X | | | | c/12 meses* | | *Realizar cada 3-6 meses en uso de TDF. |
| CPS (3) | X | | | | | | En inmunosupresión grave enfatizar búsqueda de coccidias. |
| Coinfecciones: VHB, VHC, VDRL, IgM, IgG, Toxoplasma, CMV, VEB | X | | | | | | Repetir en conducta de riesgo o signos clínicos de enfermedad. |
| Rx tórax y PPD *BAAR | X | | | | | | Repetir en caso de ser contacto, o signos clínicos de enfermedad. *Tos >4 semanas, en expectoración o jugo gástrico |
| Pruebas de tropismo | X | | | | | | Si se considera uso de inhibidores de entrada en el tratamiento. |
| HLA-B*5701 | X | | | | | | Si está disponible y se va a utilizar ABC. |
| CV; carga viral de VIH en plasma; ZDV: zidovudina; BH: biometría hemática; Cr: creatinina; BUN: nitrógeno ureico en sangre; AST/ALT: aspartato aminotransferasa/alanino aminotransferasa; CPS: coproparasitoscópico; VHB: virus de hepatitis B; VHC: virus de hepatitis C; CMV: citomegalovirus; s: semanas; ABC:abacavir. | |||||||
1.3. Recomendaciones para el abordaje de la planificación familiar para mujeres cisgénero y hombres transgénero con VIH
Algoritmo 1. Para el abordaje de la planificación familiar para mujeres cisgénero y hombres transgénero con VIH
Adaptado de: Ministerio de Salud Pública y Asistencia Social. Manual para la Atención para la Salud Sexual y Reproductiva de Mujeres que Viven con VIH y VIH avanzado (sida). Guatemala: Gobierno de Guatemala, Ministerio de Salud Pública y Asistencia Social; 2012.
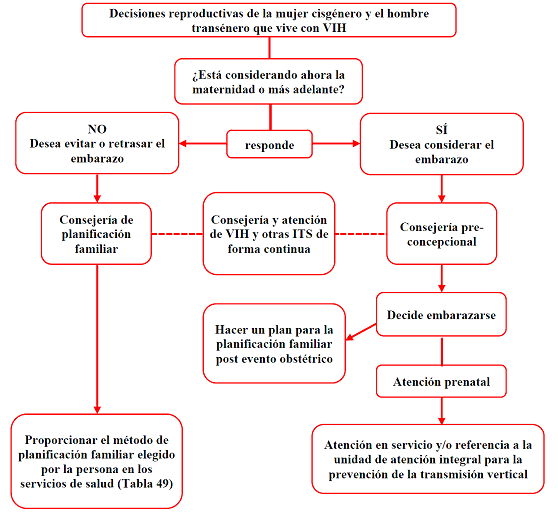
Para mayor información sobre consejería de planificación familiar y preconcepcional para mujeres cisgénero que viven con VIH se recomienda consultar la Guía de salud sexual y reproductiva para mujer y VIH del Centro Nacional de Equidad de Género y Salud Reproductiva, disponible en:
http://cnegsr.salud.gob.mx/contenidos/descargas/Estudios/prodfinalguassyrmujyvih_gs.pdf
Para mayor información sobre la atención de personas lésbico, gay, bisexual, transexual, travesti, transgénero e intersexual revisar el Protocolo para el acceso sin discriminación a la prestación de servicios de atención médica de las personas lésbico, gay, bisexual, transexual, travesti, transgénero e intersexual y guías de atención específicas de la Secretaría de Salud, disponible en:
www.gob.mx/cms/uploads/attachment/file/233408/210617Protocolo_Comunidad_LGBTTI_DT_Versi_n_III_17_3.pdf
Capítulo 2
2. Tratamiento antirretroviral en personas adultas con VIH
2.1. Cuándo iniciar el tratamiento antirretroviral
El tratamiento antirretroviral (TAR) está recomendado para todas las personas que viven con VIH, independientemente de la cuenta de células CD4 y de la presencia o no de síntomas (A-I), con el objetivo de reducir el riesgo de progresión de la enfermedad y prevenir la transmisión del VIH.
El VIH produce morbilidad y mortalidad por tres vías: 1) inmunodeficiencia; 2) daño directo a ciertos órganos blanco; y, de manera indirecta, 3) daño a estos órganos por la inflamación crónica producida por el propio virus. Los estudios realizados hasta ahora muestran que:
· En cualquier etapa de la infección, el VIH activo puede dañar al organismo.
· La terapia antirretroviral es benéfica aun iniciada en etapas avanzadas, sin embargo, la terapia tardía puede no reparar el daño producido por la replicación viral persistente que ocurrió durante las fases tempranas de la infección.
· La terapia que se inicia de manera temprana puede evitar este daño en las fases iniciales de la infección.
· Ahora se cuenta con evidencia científica, generada en ensayos clínicos controlados aleatorizados (START, TEMPRANO), que aporta mayor sustento a la recomendación del inicio temprano de la terapia antirretroviral. Estos estudios demuestran que iniciar terapia antirretroviral con una cuenta de T-CD4+ por encima de las 500 células/mm3 ofrece un claro beneficio en términos de la reducción en la incidencia de los eventos graves relacionados a Sida (por ejemplo, tuberculosis, enfermedades bacterianas invasoras y sarcoma de Kaposi), de los no relacionados a Sida (tales como neoplasias malignas) y de la mortalidad por cualquier causa.
Esta Guía promueve enfáticamente la conducta de DIAGNOSTICAR Y TRATAR LO MÁS TEMPRANO POSIBLE. Lo habitual es que las personas que viven con VIH acudan a atención médica con cuentas muy bajas de células CD4, por lo que cada vez más se promueve la realización de campañas eficientes para incrementar el diagnóstico de la infección, captar y retener en los centros de atención médica (antes de las etapas avanzadas de la enfermedad) a las personas que viven con el virus.
Quienes al momento del diagnóstico tienen una cuenta alta de células CD4, presentan una baja probabilidad de muerte en el corto plazo. El sustento para recomendar el inicio del TAR en esta circunstancia es la evidencia (cada vez mayor) de que la infección crónica no tratada (o la viremia persistente no controlada), así como la consecuente activación inmune persistente (estado de inflamación crónica) se asocian con las mencionadas enfermedades no definitorias de sida. Aunado a esto, las combinaciones de antirretrovirales son cada vez más cómodas en su toma y mejor toleradas que los esquemas del pasado.
La carga viral plasmática alta es el principal factor de riesgo para la transmisión del VIH y el uso de terapia altamente efectiva logra reducir de forma importante la viremia y la transmisión del virus a la pareja o parejas sexuales. Con base en estudios ecológicos y modelos matemáticos se considera que la expansión del uso del TAR puede resultar en una disminución de la incidencia y, eventualmente, de la prevalencia de la infección por VIH a nivel poblacional. Así, proporcionar la terapia antirretroviral a todas las personas que viven con VIH puede ser una medida altamente benéfica para la salud pública.
Se recomienda al personal médico que explique a toda persona que vive con VIH (aún en aquellas con cuenta de CD4 mayores a 500 células/mm3) que el hecho de suprimir la actividad viral mediante la terapia antirretroviral puede reducir de manera importante el riesgo de transmitir el VIH a otras personas. También, debe informárseles que la infección no tratada (aunque sea asintomática) produce un desgaste progresivo y, en ocasiones irreversible, del sistema inmune, lo que aumenta el riesgo futuro de enfermedades y muerte.
Un hecho inquietante es el abandono de la cadena de cuidados médicos por parte de personas que acuden a sus primeras citas con cuentas de CD4 elevadas, regresando cuando existen manifestaciones clínicas de sida o cuando las cuentas de células CD4 son muy bajas. Existe la posibilidad de que en las personas que viven con VIH, la terapia antirretroviral sea una motivación para permanecer regularmente bajo atención médica (tabla 3). En los casos en que las personas no deseen iniciar tratamiento antirretroviral, se recomienda al médico dejar constancia por escrito, de ello, en el expediente.
Tabla 5. Potenciales ventajas y desventajas del inicio temprano de la terapia antirretroviral
| Ventajas potenciales | Desventajas potenciales |
| Disminuye la activación inmune y el estado inflamatorio crónico. | Es un tratamiento de por vida. |
| Minimiza: 1. Desgaste del sistema inmune. 2. Evolución del VIH. 3. Diseminación del VIH a reservorios celulares y en órganos santuarios. | Requiere un óptimo cumplimiento en su toma y en caso de NO tener buena adherencia: - Desarrollo de falla virológica y resistencia viral. - Limita opciones terapéuticas subsiguientes. - Transmisión de cepas virales resistentes. - Evolución viral hacia mayor virulencia. |
| Disminuye la incidencia de enfermedades no definitorias de sida: - Cardiovasculares - Renales - Hepáticas - Neurológicas - Oncológicas | Riesgo de efectos secundarios y tóxicos de los medicamentos*: - Gastrointestinales - Cardiovasculares - Renales - Hepáticos - Cutáneos |
| Evita la presentación de infecciones oportunistas y neoplasias asociadas al sida. | Percepción de menor riesgo de transmitir o de reinfectarse por el VIH y el no cumplimiento de relaciones sexuales protegidas.** |
| Alarga la expectativa de supervivencia. | Expectativa de que la terapia es meramente un método de «sexo seguro» para tener relaciones sexuales no protegidas. |
| Evita la pérdida de pacientes de la cadena de atención médica. | Representa un mayor costo inmediato para el sistema de salud, aunque a la larga se traducirá en importantes ahorros monetarios. |
| Disminuye la posibilidad de transmisión del VIH. | |
| *Debe ponderarse que el aumento del riesgo para enfermedad cardiovascular, daño renal y óseo puede ser imputado solo parcialmente a potenciales efectos adversos a los medicamentos, pues también contribuye en su patogenia la propia replicación permanente del virus y el estado inflamatorio crónico; fenómenos que justamente se tratan de minimizar con la terapia antirretroviral. **Debe insistirse en adoptar prácticas sexuales protegidas para evitar la transmisión del VIH, así como de brotes con cepas resistentes. | |
Tabla 6. Condiciones que indican el inicio de la terapia antirretroviral lo más pronto posible
| Condición | Razón/meta | Grado |
| Embarazo (AI) | Reducción del riesgo de transmisión materno-infantil. | recomendado |
| Cuenta de células CD4 menor a 200 células/mm3 y/o historia o presencia de una enfermedad definitoria de sida (AI) | Reducción del riesgo de morbimortalidad a corto y mediano plazos. | recomendado |
| Nefropatía asociada a VIH (AII) | Mal pronóstico y rápido deterioro de la función renal. | recomendado |
| Deterioro neurocognitivo asociado al VIH (AI) | Mal pronóstico y rápido deterioro de la función neurológica. | recomendado |
| Primoinfección por VIH (particularmente en el síndrome retroviral agudo) (BII) | Posibilidad de: - Acortar tiempo de sintomatología. - Disminuir los reservorios celulares y orgánicos (santuarios) del VIH. - Minimizar deterioro inmune. - Minimizar evolución del VIH. - Reducir el alto riesgo de transmisión del virus dada la elevada carga viral y prácticas de riesgo recientes | considerar |
Tabla 7. Condiciones que llevan a considerar el "retraso" en el inicio de la terapia antirretroviral
| Condición | Razón/meta |
| - Predicción de mal cumplimiento en la toma de los medicamentos. - Falta de aceptación y convencimiento de la persona sobre los beneficios del tratamiento. | - Evitar riesgo de selección de variantes virales con mutaciones de resistencia y de su transmisión a otras personas. - Evitar agotar opciones de tratamiento efectivo a futuro. |
| Presencia de comorbilidades que complican o contraindican la terapia (cirugía, medicación concomitante con interacciones farmacológicas desfavorables, etc.) | - Riesgo de toma inadecuada de medicamentos. - Mayor riesgo de efectos adversos graves. - Posibilidad de niveles séricos subóptimos del antirretroviral. |
| Otra enfermedad en etapa terminal (cáncer, enfermedad hepática descompensada, etc.) | - Expectativa de supervivencia muy corta. |
| Cuando la cuenta de células CD4 es alta (más de 500 células por mm3) es razonable diferir la terapia antirretroviral en estas circunstancias, pero hacerlo en personas con cuentas bajas (con menos de 200 células por mm3) deberá ser en condiciones excepcionales. A veces convendrá retrasar la terapia por un periodo breve mientras se da tiempo a preparar al paciente (psicológicamente, superar barreras para una óptima adherencia) para un tratamiento que será de por vida. Cuando es imperioso el inicio de la terapia, los antirretrovirales deberán iniciarse lo más pronto posible y abocarse simultáneamente a resolver los obstáculos para el buen cumplimiento. | |
2.2. Combinación de antirretrovirales recomendados en el inicio de la terapia
Tabla 8. Esquemas recomendados en personas adultas con VIH sin tratamiento previo
| Esquemas | Comentarios | ||
| Se prefieren esquemas coformulados. | |||
| Preferentes | ABC1,2/3TC/DTG3 (AI) | Es el inhibidor de integrasa con mayor barrera genética a la resistencia. Si hay enfermedad cardiovascular o alto riesgo de ésta, prefiera un esquema sin abacavir. No recomendado en personas coinfectadas con virus de hepatitis B. Contraindicado en mujeres con potencial de embarazo. Es recomendable hacer la prueba del alelo HLA-B* 5701, y no iniciar hasta que se tenga el resultado negativo. | |
| TAF4/FTC/EVG/cobi5 (AI) | Tiene interacciones medicamentosas semejantes al ritonavir. No recomendado en personas que usen rifampicina o rifabutina. | ||
| TDF6/FTC/EVG/cobi5 (AI) | |||
| TDF7/XTC8/EFV9 (BI) | La resistencia transmitida a EFV reportada a nivel nacional en 2015 fue del 9.2%. Recomendado hacer prueba de resistencia viral basal, sin retrasar el inicio de la TAR. Especial vigilancia de control viral en pacientes con inmunosupresión severa sin acceso a genotipo. | ||
| | TDS7,10/XTC8/EFV9 (BI) | ||
| Alternativos | |||
| TAF4/FTC o TDF7/XTC8 o TDS7,10/XTC8 | RAL11 (AI) | Raltegravir, tabletas de 400 mg para su administración de una tableta cada 12 horas o tabletas de 600 mg para su administración de 2 tabletas una vez al día. | |
| DTG (AI) | Es el inhibidor de integrasa con mayor barrera genética a la resistencia. Contraindicado en mujeres con potencial de embarazo. | ||
| EFV9 (BI) | La resistencia transmitida a EFV a nivel nacional en 2015 fue del 9.2%. Recomendado hacer prueba de resistencia viral basal, sin retrasar el inicio de la TAR. Especial vigilancia de control viral en pacientes con inmunosupresión severa sin acceso a genotipo. | ||
| Etalonato de Darunavir/cobi (BI) | Tiene interacciones medicamentosas semejantes al ritonavir. No recomendado en personas que usen rifampicina o rifabutina. | ||
| Cada institución decidirá cuáles de estos esquemas se recomiendan de acuerdo a sus propias políticas. 1 Contraindicado si HLA-B* 5701 positivo 2 En escala de Framingham, riesgo mayor de 20% a 10 años 3 Evítese su administración simultánea con antiácidos con cationes divalentes (Ca2+, Mg++, Al++, Fe++) que son quelantes del DTG, reduciendo su absorción. DTG puede incrementar la concentración de creatinina sérica por disminución de la secreción tubular renal sin alterar la función glomerular, durante las primeras cuatro semanas de tratamiento, manteniéndose estable posteriormente. No se recomienda la coadministración de más de 1 gr de metformina al día. En caso de coadministración de rifampicina agregar una tableta de 50 mg de DTG a las 12h de tomada la coformulación. El análisis preliminar de un estudio observacional en curso en Botswana, encontró casos de defectos del cierre del tubo neural en 426 mujeres que quedaron embarazadas mientras tomaban DTG 0.67% vs. 0.12% en bebés nacidos de mujeres que toman otros ARV en el momento de la concepción. 4 No recomendado en personas con depuración de creatinina menor a 30 ml/min 5 Evítese su administración simultánea con antiácidos con cationes divalentes (Ca2+, Mg++, Al++, Fe++) que son quelantes del elvitegravir, reduciendo su absorción. Adminístrese junto con alimentos. Cobicistat incrementa la creatinina sérica por inhibición de la secreción tubular renal sin alterar la función glomerular, durante las primeras cuatro semanas de tratamiento, manteniéndose estable posteriormente. Cobicistat tiene interacciones farmacológicas similares al ritonavir. 6 No recomendado en personas con depuración de creatinina menor a 70 ml/min 7 No recomendado en personas con depuración de creatinina menor a 60 ml/min 8La evidencia disponible respalda la equivalencia clínica de lamivudina y emtricitabina en términos de eficacia y seguridad, por lo que la emtricitabina podrá ser sustituida por lamivudina y viceversa. 9. Ver tabla XI 10 TDS, Alternativa farmacéutica, producto que se administra por la misma vía, contienen la misma dosis molar del fármaco(s) o sustancia(s) activa(s) que pueden diferir en la forma farmacéutica (tabletas o cápsulas), en la forma química del fármaco o sustancia activa (diferentes sales, diferentes ésteres) o en ambas y que cumplen con las especificaciones de la FEUM y autorizada por la autoridad sanitaria. Corresponde a cada institución el uso y prescripción de este medicamento. 11 Evítese su administración simultánea con antiácidos con cationes divalentes (Ca2+, Mg++, Al++, Fe++) que son quelantes del raltegravir, reduciendo su absorción. Utilizar 800 mg de raltegravir cada 12 horas en caso de utilizar rifampicina ABC: abacavir; cobi: cobicistat; DTG: dolutegravir; EFV: efavirenz; EVG: elvitegravir; FTC: emtricitabina; r: ritonavir como refuerzo; RAL: raltegravir; TAF: tenofovir alafenamida; TDF: tenofovir disoproxil fumarato; TDS: tenofovir disoproxil succinato; XTC: emtricitabina o lamivudina; 3TC: lamivudina; FTC: emtricitabina. |
Tabla 9. Otros esquemas para personas adultas con VIH sin tratamiento previo.
| Esquemas | Comentarios | |
| Estos esquemas son eficaces y tolerados, pero tienen desventajas potenciales, limitaciones en algunas poblaciones específicas o menor evidencia en ensayos clínicos. | ||
| ABC1/3TC | RAL2 (BII) | Raltegravir, tabletas de 400 mg para su administración de una tableta cada 12 horas o tabletas de 600 mg para su administración de 2 tabletas una vez al día. No se ha demostrado que la respuesta viral de la combinación de RAL+ABC/3TC sea igual que con TDF/FTC en pacientes con CV-VIH más de 100,000 copias/ml. |
| EFV (BII) | La probabilidad de respuesta viral satisfactoria pudiera ser menor al combinar EFV con el eje ABC/3TC en personas con CV-VIH >100,000 copias/ml. | |
| Etalonato de Darunavir/cobi (BI) | Tiene interacciones medicamentosas semejantes al ritonavir. No recomendado en personas que usen rifampicina o rifabutina | |
| ABC1/3TC o TAF3/FTC o TDF4/XTC5 o TDS4,6/XTC5 | Darunavir ó Etanolato de Darunavir + r (BI) | Darunavir o Etanolato de Darunavir, tabletas de 400 mg para una administración diaria de 2 tabletas + una tableta de ritonavir de 100 mg. |
| 1 Es recomendable determinar el haplotipo HLA-B 5701, se requiere resultado para el inicio de la TAR. 2 Evítese su administración simultánea con antiácidos con cationes divalentes (Ca2+, Mg++, Al++, Fe++) que son quelantes del raltegravir, reduciendo su absorción. Utilizar 800 mg de raltegravir cada 12 horas en caso de utilizar rifampicina 3 No recomendado en personas con depuración de creatinina menor a 30 ml/min 4 No recomendado en personas con depuración de creatinina menor a 60 ml/min 5 La evidencia disponible respalda la equivalencia clínica de lamivudina y emtricitabina en términos de eficacia y seguridad, por lo que la emtricitabina podrá ser sustituida por lamivudina y viceversa para el tratamiento antirretroviral de las personas con VIH. 6 TDS, Alternativa farmacéutica, producto que se administra por la misma vía, contienen la misma dosis molar del fármaco(s) o sustancia(s) activa(s) que pueden diferir en la forma farmacéutica (tabletas o cápsulas), en la forma química del fármaco o sustancia activa (diferentes sales, diferentes ésteres) o en ambas y que cumplen con las especificaciones de la FEUM. Autorizada por la autoridad sanitaria. Corresponde a cada institución el uso y prescripción de este medicamento. ABC: abacavir; EFV: efavirenz; FTC: emtricitabina; RAL: raltegravir; r: ritonavir como refuerzo; TAF: tenofovir alafenamida; TDF: tenofovir disoproxil fumarato; TDS: tenofovir disoproxil succinato; XTC: emtricitabina o lamivudina; 3TC: lamivudina. FTC: emtricitabina; CV-VIH = carga viral del VIH en plasma | ||
Tabla 10. Ventajas y desventajas de los ejes de análogos de nucleós(t)idos recomendados en los
esquemas de inicio
esquemas de inicio
| | TDF/FTC | TDS/FTC | TAF/FTC | ABC/3TC |
| Ventajas | · Amplia experiencia en su uso · Eje preferido para todas las combinaciones, después de TAF · En tableta única con EFV y EVG/c · Actividad contra VHB · Se asocia a niveles de lípidos más bajos que con TAF o ABC · Puede ser tomado con o sin alimentos | · Demostró bioequivalencia con TDF/FTC en estudios en mexicanos sanos · Usado en varios países europeos, sin reporte de efectos adversos o tasa de falla diferente a TDF/FTC · Actividad contra VHB · Se asocia a niveles de lípidos más bajos que con TAF o ABC · Puede ser tomado con o sin alimentos | · Preferido a las demás combinaciones · En tableta única con EVG/c · Menor toxicidad renal y ósea que con TDF · Actividad contra VHB · Se puede usar con depuración de creatinina >30 ml/min · Puede ser tomado con o sin alimentos | · Amplia experiencia en su uso · En combinación fija con DTG · Menor toxicidad renal y ósea en comparación con TDF · Puede ser tomado con o sin alimentos |
| Desventajas | · Se asocia a disminución de la función renal, tubulopatía proximal (proteinuria y pérdida de fosfatos) y pérdida de la densidad mineral ósea · No usarse con depuración de creatinina <60 ml/min | · Aunque en el mercado de genéricos existe en combinación fija, no se registra todavía en México en régimen de tableta única. · Mismos efectos sobre función renal y densidad mineral ósea que con TDF · Sin estudios comparativos de farmacodinamia · No usarse con depuración de creatinina <60 ml/min · Alternativa farmacéutica | · Sin efecto favorable en niveles de lípidos séricos. · No recomendado en mujeres embarazadas | · No se recomienda en pacientes con coinfección activa con VHB · Puede causar reacción de hipersensibilidad, en ocasiones fatal. Se recomienda realización de prueba del alelo HLB*5701 · Puede asociarse a mayor riesgo de enfermedad cardiovascular · No se recomienda para pacientes con CV >100,000 copias/ml, a excepción de que se asocie a DTG · No usarse con depuración de creatinina <50 ml/min (3TC requiere ajuste de dosis) · No usar en conjunto con alcohol |
Tabla 11. Ventajas y desventajas de los antirretrovirales recomendados como el tercer componente de
los esquemas de inicio
los esquemas de inicio
| | Efavirenz | Dolutegravir | Elvitegravir | Raltegravir | Darunavir o Etanolato de Darunavir |
| Ventajas | - Amplia experiencia en su uso a largo plazo - Presentación en tableta única - No requiere modificación de dosis con uso concomitante de rifampicina. | - Presentación en tableta única, con o sin alimentos - Superior a EFV y Darunavir o Etanolato de Darunavir/r en ensayos clínicos - Pocos efectos adversos y bien tolerado - Perfil lipídico favorable - Bajo riesgo de desarrollo de resistencia a la falla - Pocas interacciones farmacológicas | - Presentación en tableta única - No inferior a EFV en ensayos clínicos | - Superior a Darunavir o Etanolato de Darunavir /r y no inferior a DTG, en ensayos clínicos - Inhibidor de la integrasa con mayor experiencia - Pocos efectos adversos y bien tolerado en registros a largo plazo - Perfil lipídico favorable - Pocas interacciones farmacológicas - Puede ser tomado con o sin alimentos | - Dosificación una vez al día y coformulado con cobicistat en una sola tableta - Elevada barrera genética a la resistencia - Menor posibilidad de falla y resistencia del VIH ante el incumplimiento en su toma |
| | - Alta frecuencia de efectos adversos neuropsiquiátricos que comprometen el apego; riesgo aumentado de depresión y posible de suicidio - Baja barrera genética a la resistencia. Potencial de dislipidemia, rash, hepatotoxicidad y prolongación del intervalo QTc - Inadecuado para poblaciones especiales: personas con trabajo nocturno, horarios prolongados de trabajo/estudio, uso de maquinaria o equipo que requiere alta precisión, adolescentes y personas adultas mayores, personas que se someten a una prueba de antidoping | - Absorción disminuida con uso simultáneo de antiácidos - Interacción con Metformina a partir de 1 g/día. - Posibles efectos neuropsiquiátricos - Elevación de creatinina sérica por inhibición de su secreción tubular - Doble dosis en combinación con rifampicina (50 mg c/12h) - En coformulación, la tableta es de mayor tamaño - Asociado a defectos en el cierre del tubo neural. | - Absorción disminuida con uso simultáneo de antiácidos - Requiere tomarse con alimentos - Requiere reforzamiento con cobicistat - Múltiples interacciones farmacológicas desfavorables por el cobicistat - Posibles efectos neuropsiquiátricos | - Absorción disminuida con uso simultáneo de antiácidos - Dosificación dos veces al día y sin coformulación - Potencial elevación de CPK, miopatía y rabdomiolisis - Posibles efectos neuropsiquiátricos - Baja barrera genética a la resistencia - Alto costo | - Requiere reforzamiento con ritonavir o cobicistat - Potencial de intolerancia gastrointestinal, rash y hepatotoxicidad - Posible mayor riesgo de enfermedad cardiovascular - Múltiples interacciones farmacológicas |
| Desventajas | - Frecuencia significativa de resistencia transmitida del VIH - Interacciones farmacológicas Requiere toma en ayuno | - Contraindicado en mujeres con potencial de embarazo o con embarazo menor de 8 semanas. | - Elevación de creatinina sérica por inhibición en la secreción tubular por el cobicistat. Recomendado solo en pacientes con depuración de creatinina > 70 ml/min. - Contraindicado con rifampicina | - No se ha demostrado que la respuesta viral de su combinación con ABC/3TC sea igual que con TDF/FTC o TDS/FTC en pacientes con carga viral más de 100,000 copias/ml | - Elevación de creatinina sérica por inhibición en la secreción tubular por el cobicistat. No recomendado en pacientes con depuración de creatinina menor a 70 ml/min y que reciben tenofovir. - Múltiples interacciones farmacológicas - Inferior a DTG y RAL en ensayos clínicos - Se debe coadministrar con alimentos - Alto costo |
Tabla 12. Definición de eventos de la viremia por VIH
| Término | Definición | Observación |
| Respuesta virológica óptima | Carga viral del VIH en plasma (CV-VIH) por debajo del nivel de detección de manera persistente e ininterrumpida. | |
| Falla virológica | Dos CV-VIH consecutivas por encima de 200 copias/ml a partir de los 6 meses de iniciado la TAR. | Respuesta incompleta: si a los 2 meses de iniciada la terapia antirretroviral (o del cambio de tratamiento) la CV-VIH no ha disminuido al menos 1 logaritmo10, o a los 6 meses la carga viral es repetidamente igual o mayor de 200 copias/ml. Pérdida del control viral (rebote): CV-VIH repetidamente por encima de las 200 copias/ml, a partir de los 6 meses de iniciada la TAR, tras haber obtenido el control viral. |
| «Blip» | Una sola CV-VIH por encima del nivel de detección pero menor a las 1,000 copias/ml, precedida y seguida de una CV-VIH por debajo del nivel de cuantificación. | Habitualmente no se asocia a mayor riesgo de desarrollo de resistencia y/o falla al control viral a futuro. Repita CV-VIH lo antes posible, no mayor a 6 semanas (ver algoritmo 2). |
| Viremia persistente de bajo nivel | Más de una CV-VIH consecutiva por encima del nivel de detección pero menor a 200 copias/ml. | Si es durante un periodo corto, se desconoce (datos inconsistentes) si se asocia a mayor riesgo de desarrollo de resistencia del VIH y/o falla al control viral a futuro. Si es durante un periodo largo, se puede asociar a mayor riesgo de desarrollo de resistencia del VIH y/o falla al control viral a futuro y/o a activación inmune persistente. |
El objetivo de un esquema de rescate a la falla del tratamiento inicial o de primera línea, es mantener al paciente con cargas virales no cuantificables de manera persistente y con medicamento con los menores efectos colaterales posibles. Ante la falla a un primer esquema se recomienda inicialmente la siguiente conducta (Tabla 13).
Tabla 13. Conducta a seguir ante la sospecha de falla al control viral
| 1. Revise la potencia esperable del esquema al que se está fallando. |
| 2. Mida el grado de cumplimiento en la toma de los medicamentos, utilizando algún cuestionario estructurado y validado (ej. ACTG). |
| 3. Si el cumplimiento en la toma de los medicamentos es menor al 95%, investigue los posibles condicionantes del mal apego (intolerancia a los medicamentos, olvidos, depresión, abuso de sustancias, falta de correcta información médica, etc.) |
| 4. Evalúe posible efectos adversos de los ARV. |
| 5. Investigue posibles interacciones farmacológicas desfavorables con el esquema fallido (medicamento-medicamento, alimento-medicamento, herbolaria-medicamento). |
| 6. Evalúe aspectos socioculturales. |
| 7. Considere coinfecciones como tuberculosis, hepatitis B, C y sífilis |
| 8. Averigüe inmunizaciones recientes |
| 9. Si se documenta que el cumplimiento en la toma de medicamentos es adecuado y persiste la falla, realice prueba de resistencia viral (genotipo) estando recibiendo el esquema fallido (o durante un tiempo máximo de 4 semanas de haberlo suspendido) y con carga viral mayor a 1,000 copias/ml. |
| 10. En caso de que hubieran existido cambios previos de los ARV por intolerancia, toxicidad o simplificación, estando bajo control viral, obtenga el historial: componentes, fecha y razones del cambio. |
| 11. Documente el tiempo en falla al control viral. |
| 12. De no contar con prueba de resistencia, prediga los ARV cuya actividad hubiera disminuido, de acuerdo con los componentes del esquema fallido y el tiempo en falla y diseñe un esquema de rescate empírico (ver tabla 15). |
| 13. Tan pronto identifique la falla al control viral, realice los puntos anteriores y tome acciones: mejorar la adherencia y/o cambiar a un esquema de rescate. Actúe con el menor retraso posible para evitar la selección y acumulación de variantes virales con cada vez más mutaciones de resistencia. |
| 14. Tenga presente que puede solicitar asesoría a un comité asesor especializado. |
| ACTG, por sus siglas en inglés: Cuestionario de adherencia del grupo clínico de sida de Estados Unidos de América |
Tabla 14. Principios del abordaje ante la sospecha de falla al control viral
| Si la carga viral está por encima de 50 y por debajo de 200 copias/ml (viremia de bajo nivel): |
| 1. Mida y asegure que la adherencia sea mayor del 95%. |
| 2. Repita la carga viral al mes de haber logrado una óptima adherencia. |
| 3. Considere coinfecciones como tuberculosis, hepatitis B, C o sífilis |
| 4. Continúe la vigilancia virológica con CV cada 6 meses. |
| 5. Si después de 12 meses persiste la viremia entre 50 y 200 copias/ml, consulte a un comité especializado. |
| Si la carga viral está entre 200 y 1,000 copias/ml: |
| 1. Mida y asegure que la adherencia sea mayor del 95%. |
| 2. Repita la carga viral al mes de haber logrado una óptima adherencia. |
| 3. Si persiste la falla virológica considere lo más pronto posible un cambio empírico basado en el tipo de esquema fallido y en las razones de cambios previos (tabla 20). |
| Si la carga viral está repetidamente por encima de las 1,000 copias/ml: |
| 1. Mida y asegure que la adherencia sea mayor del 95%. |
| 2. Realice genotipo viral. |
| 3. Si no se identifican mutaciones de resistencia, insista en que haya un óptimo apego, averigüe intolerancia a los ARV e insista en conocer las causas del incumplimiento, de preferencia con el apoyo de un equipo multidisciplinario. |
| 4. Si se identifican una o más mutaciones de resistencia, diseñe y cambie lo más pronto posible a un esquema de rescate basado en las mutaciones de resistencia identificadas y en las razones de cambios previos. De ser necesario, consulte a comité especializado. |
Algoritmo 2. Para el abordaje de los pacientes con carga viral cuantificable tras haberse logrado una
óptima respuesta virológica
óptima respuesta virológica

Tabla 15. Esquemas recomendados para el rescate tras la falla al primer esquema de TAR
| Tercer ARV en el esquema fallido | Genotipo | Rescate con: | ||
| SE RECOMIENDA QUE EN TODAS LAS FALLAS AL CONTROL VIRAL SE SOLICITE GENOTIPO, SIN RETRASAR EL RESCATE Y AJUSTAR ACORDE AL RESULTADO DE ESTE ESTUDIO Si considera necesario, solicite oportunamente la asesoría por el comité correspondiente | ||||
| EFV o NVP* | Sin genotipo o en espera de resultado | TAF/FTC o TDF/XTC o TDS3/FTC4 | Etalonato de Darunavir 800 mg/cobi QD (BIII)* o Darunavir ó Etalonato de Darunavir 800 mg *+r 100 mg QD (BI) o LPV/r (AI) | |
| Cambiar acorde al resultado del genotipo, favoreciendo un esquema más simple y tolerable | Al menos un ITRAN activo | Eje con 2 ITRAN | DTG (BI) o Etalonato de Darunavir 800 mg /cobi QD (BIII) o Darunavir ó Etalonato de Darunavir 800 mg + r 100 mg QD * (BI) | |
| Ningún ITRAN activo | Eje con 2 ITRAN + LPV/r (AI) | |||
| Solicitar al comité asesor LPV/r + RAL (AI) | ||||
| SQV+r o ATV+r o LPV/r o Darunavir o Etanolato de Darunavir +r | Realizar genotipo y reforzar adherencia | Genotipo sin mutaciones o solo compromiso de 3TC/FTC | TAF/FTC o TDF/XTC o TDS/FTC | Etalonato de Darunavir 800 mg/cobi QD*(BIII) o Darunavir ó Etalonato de Darunavir 800 mg +r 100 mg QD *(BIII) |
| Genotipo con mutaciones en gen de la proteasa | Solicite oportunamente la asesoría por el comité correspondiente | |||
| EVG o DTG o RAL | Se recomienda que en todas las fallas a un esquema con inhibidor de la integrasa se solicite, adicional al genotipo convencional, el estudio del gen de la integrasa | |||
| Con resultado del genotipo** | TAF/FTC o TDF3/XTC o TDS3/FTC | Etalonato de Darunavir 800 mg/cobi QD*(BIII) o Darunavir ó Etalonato de Darunavir 800 mg + r 100 mg QD *(BIII) o LPV/r (BIII) | ||
| Sin genotipo o en espera de resultado | ||||
| * Utilizar Darunavir o Etanolato de Darunavir 600 mg + r 100 mg BID si el paciente tiene carga viral con más de 100 mil copias/ml o si no está disponible Etalonato de Darunavir/cobi o tabletas de Darunavir o Etanolato de Darunavir 400 mg. **No hay evidencia publicada de la eficacia y durabilidad del rescate con DTG en estas circunstancias. Consultar el algoritmo de la Universidad de Stanford, disponible en https://hivdb.stanford.edu/ No introduzca un nuevo ARV con posibilidades de resistencia cruzada (ej. EVGDRAL). La meta de control viral con el esquema de rescate deberá ser la misma definida para el tratamiento inicial. QD: una vez al día; BID: dos veces al día;; DTG: dolutegravir; FTC: emtricitabina; cobi: cobicistat; ITRAN: inhibidor de la transcriptasa reversa análogo de nucleós(t)ido; qd: una vez al día; RAL: raltegravir; r: ritonavir como refuerzo; Etanolato de Darunavir/cobi: Etanolato de Darunavir 800 mg coformulado con 150 mg de cobicistat; TAF: tenofovir alafenamida; TDF: tenofovir disoproxil fumarato; TDS: Tenofovir disoproxil succinato; XTC: emtricitabina o lamivudina; 3TC:lamivudina: FTC emtricitabina. | ||||
2.4. Tratamiento de rescate de la falla al control viral tras múltiples esquemas y/o con infección por un virus resistente a medicamentos de varias clases de antirretrovirales
El objetivo de un esquema de rescate avanzado es lograr que la persona mantenga mediciones de cargas virales por debajo del nivel de cuantificación de manera permanente.
Dada la complejidad del manejo, es recomendable que la falla en la persona multiexperimentada sea evaluada y resuelta mediante la consulta y el apoyo por especialistas de alguno de los comités institucionales.
Tabla 16. Principios del rescate avanzado
| 1. Disponer de una historia completa de los esquemas de ARV incluyendo las razones de los cambios (simplificación, falla al control viral, falta de apego y sus determinantes, tipo de intolerancia y de toxicidad a los medicamentos, interacciones farmacológicas, coinfecciones, desabasto, etc.) |
| 2. Realizar un ensayo genotípico de resistencia, y de ser necesario tropismo, cuando el paciente se encuentre recibiendo el tratamiento en falla. Mientras se inicia el esquema de rescate, el paciente se puede mantener en contención (comúnmente monoterapia con 3TC o FTC) para evitar la acumulación de mutaciones de resistencia. |
| 3. No se recomienda la toma de pruebas de resistencia cuando el paciente haya suspendido su tratamiento, ya que esto puede llevar a errores de interpretación, es decir, la subestimación de la resistencia por la no identificación de variantes virales (minoritarias) con mutaciones que afectan la actividad de los ARV. En caso de contar con ensayos previos, se deberán evaluar conjuntamente. |
| 4. Con base en lo anterior, diseñar y prescribir un esquema de rescate con al menos dos, y de preferencia tres agentes totalmente activos. Siempre que sea posible, debe procurarse que uno de ellos sea un inhibidor de proteasa. |
| 5. Vigilar estrechamente sus efectos indeseables y la respuesta virológica. |
| 6. Si solo existe un ARV totalmente activo como opción terapéutica, se recomienda reservar esta opción para asociarlo en un futuro con medicamentos activos (no disponibles o en proceso de aprobación) y prescribir temporalmente un esquema de contención, mientras se espera la asesoría del comité. |
| 7. Cuando la supresión viral no es completa con las opciones disponibles se recomienda agregar medicamentos como lamivudina o emtricitabina, aunque ya hayan demostrado no tener actividad, debido a que presionan al predominio de cepas virales con una capacidad de replicación viral baja; esto puede controlar el descenso de CD4. |
| 8. Procurar y vigilar que la adherencia a la toma de medicamentos sea de por lo menos el 95%; no es raro que el esquema de rescate avanzado sea la última opción eficaz. |
2.5. Uso de pruebas virales de resistencia a antirretrovirales
El fenómeno de la resistencia a los ARV es uno de los principales determinantes de la falla al control viral y su estudio es de relevancia en la selección de tratamientos de rescate y en la comprensión de la resistencia cruzada y de la resistencia transmitida.
Las pruebas de resistencia ofrecen información únicamente de variantes virales predominantes; es decir, de aquellas cuya frecuencia sea mayor del 18% de la población total. Este hecho significa que estos ensayos no detectan mutaciones en subpoblaciones virales minoritarias (o archivadas como DNA viral integrado en el genoma de la célula humana). Estas variantes virales son minoritarias porque el tratamiento actual ejerce una insuficiente presión selectiva o porque fueron seleccionadas por un tratamiento previo (falta de presión selectiva farmacológica actual). El ensayo de resistencia debe realizarse cuando el tratamiento ARV está siendo administrado, ya que, si se ha suspendido, las variantes susceptibles tienden paulatinamente a ocupar la población mayoritaria por ser más aptas para replicarse. www.google.com
Si se reporta resistencia, este hallazgo es un buen predictor de falla si se usa el medicamento en cuestión. Si se reporta susceptibilidad, este hallazgo no garantiza que el medicamento vaya a funcionar ante la posibilidad de variantes minoritarias con mutaciones. Los ensayos de uso común son útiles solo cuando la CV es mayor a las 1,000 copias/ml. El resultado (algoritmo) automatizado del genotipo implica una interpretación que no siempre es exacta al no tomar en cuenta el historial del paciente.
2.5.1. Uso de los ensayos de resistencia
Se recomienda el uso de ensayos genotípicos en la mayoría de las situaciones clínicas (AI). Se debe considerar el uso de ensayos fenotípicos, tanto reales como virtuales, únicamente en casos de uso de nuevos medicamentos cuyos patrones de resistencia no sean bien conocidos y en pacientes con historia de uso de múltiples antirretrovirales y/o con la presencia de múltiples mutaciones virales (CI). Los ensayos de resistencia se recomiendan en las condiciones enumeradas en la tabla 16.
Tabla 17. Recomendaciones para el uso de los ensayos de resistencia a ARV
| Situación | Recomendación | Comentarios |
| Infección crónica previo a TAR | Evaluar (BII) | Acorde a factores de riesgo individuales y prevalencia poblacional |
| Infección aguda | Realizar(AII) | Determinar transmisión de cepas resistentes. |
| Infección crónica | Evaluar (BII) | Determinar transmisión de cepas resistentes, en especial en situaciones de alta probabilidad. |
| Embarazo | Realizar(AI) | Guiar decisiones terapéuticas, de preferencia antes de inicio del tratamiento |
| Falla virológica en tratamiento | Realizar(AI) | Para guiar decisiones terapéuticas. En especial en pacientes con fallas múltiples. |
| Supresión virológica subóptima después de inicio TAR | Evaluar(AII) | Guiar decisiones terapéuticas ante la posibilidad de mal apego, resistencia transmitida, etc. |
| Más de 4 semanas después de suspender tratamiento | No realizar(BI) | Subestimación de la presencia de mutaciones. |
| Con CV menores a 1,000 copias/ml. | No realizar(AI) | Insuficiente material genético para amplificar. |
2.6. Seguimiento de las personas con tratamiento ARV
Tabla 18. Recomendaciones en el monitoreo del efecto del TAR en la viremia y en la reconstitución
inmune
inmune
| · La CV debe medirse antes del inicio del tratamiento, a las 12 y 24 semanas del inicio o cambio de la TAR y, posteriormente, cada cuatro meses hasta constatar la supresión persistente de la viremia por debajo de las 50 copias/ml durante un mínimo de un año. |
| · La cuenta absoluta y porcentual de células CD4 debe medirse cada tres o cuatro meses tras el inicio de TAR, particularmente en pacientes con cuentas menores a las 200 células/mm3, para determinar la necesidad de inicio o suspensión de la profilaxis primaria (o secundaria) de infecciones oportunistas. |
| · Una vez suprimida la viremia durante un año, si la cuenta de célulasCD4 es mayor a las 350 células/mm3 y el o la paciente tiene buen apego con la toma de los ARV, la CV y el conteo celular pueden realizarse a intervalos de hasta 6 meses. |
| · Si se detecta viremia persistente por encima de las 200 copias/ml, estando la persona bajo TAR, consultar la sección de falla viral. |
| · Si tras el diagnóstico de la infección por VIH, la persona no inicia el TAR, el seguimiento del conteo de células CD4 deberá realizarse cada cuatro meses para detectar oportunamente la urgencia de comenzar la terapia, así como de la profilaxis de infecciones oportunistas. |
| · El monitoreo de otras subpoblaciones linfocitarias (tal como las células T CD8) no ha probado tener una utilidad clínica y no se recomienda su medición rutinaria. |
2.7. Estrategias de cambio de medicamentos ARV en personas bajo control virológico
2.7.1. Generalidades
El objetivo de la terapia antirretroviral es llevar a la persona a la indetectabilidad de la carga viral plasmática; sin embargo, una vez logrado esto, es posible que existan razones no virológicas importantes para modificar la terapia, efectos adversos o que sea conveniente disminuir el número de dosis, por lo que existe la alternativa de cambio. Es importante considerar que en un cambio con carga viral indetectable debe procurarse cambiar a medicamentos que sigan siendo igualmente activos (tabla 18).
La meta principal en la modificación de la terapia es el mantenimiento de la supresión virológica. Esta modificación puede ser "proactiva" para evitar eventos adversos, toxicidad o interacciones medicamentosas; o "reactiva" cuando la modificación se realiza después de la presentación de alguno de los eventos.
Para llevar a cabo esta estrategia de cambio, es necesario que la carga viral del VIH se encuentre indetectable (menor a 20, 40 o 50 copias/ml, de acuerdo a la técnica usada), idealmente por lo menos durante los últimos seis meses. Cuanto más prolongado sea el periodo de supresión virológica, es menos probable que el cambio de TAR se asocie a fracaso al control virológico.
En pacientes con supresión virológica y antecedente de falla al control viral o de haber recibido múltiples esquemas, la modificación del tratamiento debe ser realizada cuidadosamente. Si se cambia un medicamento de alta barrera genética a un medicamento de baja barrera genética, es esencial que el nuevo régimen contenga al menos tres medicamentos totalmente activos.
Antes de modificar un esquema antirretroviral supresor de las cargas virales se recomienda: que éstas hayan sido indetectables durante por lo menos seis meses antes y que exista una expectativa de buena adherencia.
2.7.2. Indicaciones
Las indicaciones para realizar un cambio de medicamento en personas con carga viral indetectable son las siguientes:
1. Cambio por toxicidad, dentro de esta indicación hay varias situaciones:
a. Toxicidades o eventos adversos documentados.
b. Toxicidades posibles por interacciones medicamentosas.
c. Para evitar toxicidades a largo plazo.
En este caso, aunque el efecto no se haya presentado, se decide hacer un cambio anticipado para evitarlo a largo plazo. Asimismo, entran en esta categoría pacientes de más de 50 años, o con comorbilidades y en quienes se prevé pudieran presentar deterioro de su estado de salud con los medicamentos que reciben.
2. Cambio para simplificación
a. Mejorar la adherencia al disminuir la frecuencia de la dosis y cantidad de pastillas.
b. Evitar administración parenteral.
c. Evitar la necesidad de alta ingesta hídrica o interacciones con alimentos.
Esta indicación aplica cuando existe una presentación coformulada de dos o más de los medicamentos que se están administrando, u otros medicamentos que requieran menos tomas al día, con lo que se intenta facilitar el apego al tratamiento. También, cuando la combinación de medicamentos ya no es un esquema indicado o recomendado en el momento actual, por mayor riesgo de resistencia viral.
3. Optimizar la terapia antirretroviral durante el embarazo o en caso de que haya posibilidad del mismo.
Al realizar el cambio de un medicamento se debe asegurar que el régimen sea lo suficientemente potente para mantener la supresión virológica.
Tabla 19. Principios para el cambio de esquema ARV
| 1. Revisar cuidadosamente toda la historia de TAR de la persona y determinar la causa de los cambios (falla al control viral, intolerancia, toxicidad, deseo de la persona, etc.) |
| 2. Tratar de cambiar medicamentos de difícil administración o habitualmente con mayor intolerancia (ej. enfuvirtida). |
| 3. Evitar cambiar a medicamentos cuya actividad pudiera ya estar comprometida por la presencia documentada (o sospechada) de mutaciones virales de resistencia, o por sospecha de resistencia viral cruzada, en caso de falla previa a medicamentos de la misma clase. |
| 4. Evitar interacciones medicamentosas importantes (ej. rifampicina). |
| 5. Cambiar un solo medicamento cuando existe un efecto adverso específico a un ARV (este cambio puede ser intraclase o por medicamentos de otro grupo o mecanismo de acción). |
| 6. Cambiar, de preferencia, de un medicamento de menor barrera genética a la resistencia a uno que tenga mayor, o al menos la misma barrera. |
| 7. Cuando el cambio sea por un medicamento con menor barrera genética a la resistencia se debe asegurar que los otros medicamentos del esquema sean completamente activos y tomar en cuenta la posibilidad de mutaciones virales «archivadas». |
| 8. Cuando se requiera asesoría sobre cambio de esquema puede solicitarla al comité correspondiente. |
| 9. La educación del paciente es fundamental en el contexto de la necesidad de un alto nivel de adherencia al nuevo esquema de tratamiento. |
2.7.3. Cambios que se deben evitar
Cambio a medicamentos o esquemas no recomendados como por ejemplo a:
· Inhibidores de proteasa no reforzados.
· Monoterapia con inhibidores de proteasa.
· Estavudina, didanosina, saquinavir y fosamprenavir.
· Combinación de dos o tres análogos nucleósidos (sin ARV de otra clase).
· A medicamentos de menor barrera genética a la resistencia o con potencial de actividad comprometida.
2.7.4. Tablas de cambios de medicamentos más frecuentes en pacientes con carga viral indetectable
Tabla 20. Cambio de medicamentos ARV en personas bajo control virológico
| Esquema o ARV usados | Sugerencia de cambio | |
| Cambio a medicamentos coformulados | ||
| TDF + FTC | Cambio a TDF/XTC o TDS/FTC o TAF/FTC coformulados | |
| ABC + 3TC | Cambio a ABC/3TC coformulados | |
| TDF + FTC + EFV | Cambio a TDF/FTC/EFV ó TDS/FTC/EFV coformulados | |
| ABC/3TC + DTG | Cambio a ABC/3TC/DTG | |
| Darunavir o Etalonato de Darunavir 800 mg QD +r | Cambio a Etanolato de Darunavir/cobi | |
| Cambio de ARV por optimización de esquemas actualmente no recomendados | ||
| En 1° línea o sin falla previa | ATV+r o LPV/r o ZDV/3TC o NVP | Cambio a esquemas recomendados de tableta única (Ver tabla 8) |
| Combinación de dos IP reforzados (ej. LPV/r + ATV o SQV) | Se recomienda un solo IP/r reforzado y agregar uno o dos medicamentos con actividad completa. Evaluación por un comité asesor especializado | |
| ABC: abacavir; ATV: atazanavir; EFV: efavirenz; FTC: emtricitabina; LPV: lopinavir; NVP: nevirapina; QD: una vez al día; RAL: raltegravir; r: ritonavir como refuerzo; SQV: saquinavir; TAF: tenofovir alafenamida; TDF: tenofovir disoproxil fumarato; TDS: Tenofovir disoproxil succinato; XTC: emtricitabina o lamivudina; ZDV: zidovudina; 3TC: lamivudina; FTC: emtricitabina |
Tabla 21. Cambio por toxicidad o efectos secundarios
| Evento adverso o tóxico existente o potencial | ARV responsables | Sugerencia de cambio | Comentarios |
| Recordar hacer reporte de eventos adversos | |||
| Alteraciones de SNC, efectos neuropsiquiátricos: somnolencia, ideas suicidas, alteraciones sueño, depresión, alteraciones cognitivas | EFV | Coformulación de EVG y DTG o RAL | Previa evaluación por un comité asesor especializado. |
| Etanolato de Darunavir /cobi o Darunavir ó Etalonato de Darunavir +r | |||
| Disminución significativa de la densidad mineral ósea (Z o T score menos de 2) o fracturas patológicas | TDF TDF/XTC TDS/FTC | ABC o ABC/3TC o TAF/FTC | Determinar la repercusión clínica. Si hay infección crónica activa por VHB cambiar el TDF y agregar otro agente activo para VHB (ej. entecavir). |
| Efectos gastrointestinales: nausea, diarrea | LPV/r Otros IP/r | IP/r con menor dosis de ritonavir (ATV+r, Darunavir ó Etalonato de Darunavir +r o Etanolato de Darunavir/cobi en una dosis al día) o INNTR | Hacer cambio solo en pacientes sin historia de falla al control viral; de lo contrario, solicitar asesoría por el comité adhoc. |
| EVG coformulado, DTG, RAL | |||
| Dislipidemia: · Hipertrigliceridemia (>500 mg/dl) con o sin LDL elevados · Hipercolesterolemia (LDL >130 mg/dl) persistente a pesar de dieta e hipolipemiantes eficaces. | IP/r | IP/r con menor dosis de ritonavir o un inhibidor de integrasa, previa evaluación por un comité asesor especializado. | |
| EFV | |||
| Eventos cardiovasculares o riesgo de los mismos(>20% en 10 años de acuerdo a escala de Framingham) | ABC | TDF o TDS o TAF | |
| LPV/r | A un inhibidor de proteasa reforzada o un inhibidor de integrasa, previa evaluación por un comité especializado. | ||
| Diabetes Mellitus | LPV/r | IP/r con menor dosis de ritonavir o INNTR | Los resultados de los cambios por esta causa han sido inconsistentes. Evaluar otros factores (ej. obesidad). RAL previa evaluación por un comité asesor especializado. |
| Lipohipertrofia | Otros IP/r | IP/r con menor dosis de RTV o INNTR | No existe evidencia clínica de que el cambio revierta los efectos. Darunavir o Etalonato de Darunavir +r o RAL, previa evaluación por un comité asesor especializado. |
| Daño renal | TDF o TDS | ABC | De preferencia, hacer el cambio temprano. Darunavir o Etalonato de Darunavir +r o RAL, previa evaluación por comité asesor especializado. |
| LPV/r | INNTR | ||
| Reacción de hipersensibilidad | ABC | TDF o TDS o TAF | Esta reacción es rara en México por factores genéticos. De sospecharse no utilizar nuevamente ABC. Descartar reacción por hipersensibilidad a otros medicamentos. |
| Endurecimiento de piel y tejido subcutáneo por inyecciones repetidas | T-20 | RAL o DTG | Evaluación por un comité asesor especializado. En el caso de cambio a maraviroc éste solo se realiza si el tropismo viral es R5. |
| EFV: efavirenz; IP: inhibidor de proteasa; r: ritonavir; RAL: raltegravir; TAF: tenofovir alafenamida; TDF: tenofovir disoproxil fumarato; TDS: tenofovir disoproxil succinato; FTC: emtricitabina; ABC: abacavir; 3TC: lamivudina; ATV: atazanavir; VHB: virus de hepatitis B; ZDV: zidovudina; IP/r: inhibidores de proteasa reforzados con ritonavir LPV: lopinavir; ATV: atazanavir; T-20: enfuvirtida. | |||
Tabla 22. Cambio por interacciones con medicamentos
| ARV | Medicamentos con los que interactúa | Cambio o manejo sugerido |
| ZDV | Ribavirina e Interferón pegilado alfa- 2a | Cambiar ZDV por TDF o TDS o ABC cuando sea posible de acuerdo con el historial de tratamientos. De no ser posible, se debe de pensar en medicamentos de otras clases. |
| IP/r | Rifampicina | De ser necesario continuar con IP/r solo usar LPV/r a dosis de 400mg c/12 h del RTV. Sustituir por EFV o RAL o 3 o 4 nucleósidos. Estos cambios pueden ser solo durante el tiempo de duración del tratamiento con rifampicina o prolongarse de acuerdo con la situación de la persona. |
| ATV+r | Inhibidores de bomba de protones | De ser necesarios, por enfermedad ácido-péptica persistente, se recomienda cambiar a LPV/r o Darunavir ó Etalonato de Darunavir +r. |
| NVP | Rifampicina | EFV |
| Maraviroc | Rifampicina | Evaluación por un comité asesor especializado. |
| ZDV: zidovudina; TAF: tenofovir alafenamida; TDF: tenofovir disoproxil fumarato; TDS: tenofovir disoproxil succinato; ABC: abacavir; IP/r: inhibidores de proteasa reforzados con ritonavir; LPV: lopinavir; r: ritonavir; EFV: efavirenz; RAL: raltegravir; ATV: atazanavir; INNTR: inhibidor no nucleósidos de la transcriptasa reversa; NVP: nevirapina. | ||
2.7.5. Consideraciones sobre inhibidores de proteasa reforzados
Un IP reforzado puede ser cambiado a un INNTR, raltegravir o cobicistat/elvitegravir/emtricitabina/tenofovir sólo si se puede garantizar la completa actividad de los dos INTR (u otros agentes) restantes en el régimen.
2.8. Apego al tratamiento
2.8.1. Definición e importancia
El «apego» o la «adherencia» se refieren al grado de cumplimiento de la persona a las indicaciones médicas, incluyendo las terapias prescritas, la asistencia a sus citas de seguimiento, las recomendaciones dietéticas y de ejercicio físico, etc.
El éxito del tratamiento antirretroviral depende de varios factores, incluyendo, por mucho, el mantener un óptimo cumplimiento en la toma de los medicamentos. Por este motivo, se ha denominado al apego como «el tendón de Aquiles» de la terapia antirretroviral. El mal apego es la determinante más frecuente de la falta de control de la replicación viral, de la selección de variantes del VIH con resistencia, de la falta de reconstitución inmune y de la progresión de la enfermedad.
En pocos padecimientos médicos se requiere un apego tan estricto al tratamiento como en el TAR. Cuando hay adherencia subóptima, es decir, menor al 95% de las tomas indicadas, sus consecuencias son importantes, no solo en la propia persona, sino también para el resto de la población, al seleccionarse virus resistentes que pueden ser transmitidos a otras personas. La adherencia deficiente se define como:
· Dificultades para iniciar el tratamiento, suspensión momentánea o abandono definitivo del mismo.
· Cumplimiento incompleto o insuficiente de las indicaciones, olvido (o equivocación) en la toma, dosis, tiempo y propósito de los medicamentos.
· Falta de cambios de hábitos y estilos de vida necesarios para el mejoramiento de la salud.
· Automedicación, incluyendo la toma de otros fármacos o sustancias (como aquellas provenientes de la herbolaria) con interacciones farmacológicas desfavorables con los ARV.
Existen múltiples factores asociados a una baja adherencia en el tratamiento ARV, como son las características y actitudes propias del paciente, del personal de salud y del tratamiento ARV (tabla 23). Condiciones como contar con bajos ingresos, falta de acceso al transporte, el género, el estigma y la discriminación continúan siendo barreras en la atención. (BII)
La inequidad de género, relacionada con cuestiones culturales y económicas, es una barrera importante en el acceso y adherencia de las mujeres al TAR. Una mayor desinformación en temas de salud sexual y reproductiva, menor independencia económica, mayor estigma social para mujeres que viven con VIH y otras formas de violencia de género se traducen en obstáculos durante el tratamiento. Se recomienda consultar la Guía de Salud Sexual y Reproductiva para Mujeres y VIH, del Centro Nacional de Equidad y Género y Salud Reproductiva.
Tabla 23: Factores comúnmente relacionados con la falta de adherencia al tratamiento antirretroviral
| De los pacientes | Del personal de salud | Del tratamiento | |
| Características | Actitudes | ||
| - Ausencia de apoyo social o familiar. - Bajo nivel socioeconómico. - Bajo nivel escolar. - Vivienda inestable. - Uso activo de drogas. - Alcoholismo. - Comorbilidad psiquiátrica (ej. Depresión). - Mala calidad de vida relacionada con la salud. - Falta de conocimientos y creencias erróneas acerca de la enfermedad y de su tratamiento. - Edad. - Sexo. - Dificultad de acceso a los servicios médicos. - Condición migrante. - Religión. - Discriminación de género. - Orientación sexual. - Condición indígena. | - Desconfianza u hostilidad hacia las y los profesionales de la salud. - Escepticismo sobre la utilidad, eficiencia o seguridad del tratamiento. - Exageración del temor a los efectos adversos del tratamiento. - Vergüenza (estigma social). - Fatalismo (pesimismo sobre el pronóstico). - Percepción de invulnerabilidad. - Baja autoestima. - Insatisfacción con la atención médica o en la relación con su médico/a. - Incapacidad de anticipar las soluciones a circunstancias no rutinarias (ej. Viajes, eventos sociales). | - Falta de interés por la enfermedad y sus retos. - Insuficientes conocimientos acerca de la enfermedad y su tratamiento. - Homofobia. - Insatisfacción laboral. - Estilo de interlocución autoritaria o prepotente hacia las y los pacientes. - Falta de disposición para interactuar y escuchar a las y los pacientes. - Actitud distante o impersonal. - Inaccesibilidad para la consulta y resolución de dudas, inquietudes, problemas, del paciente. - Prejuicios. - Desabasto de recursos. - Misoginia. - Falta de consentimiento informado de la persona para la aceptación del tratamiento antirretroviral. | - Número de pastillas. - Frecuencia de dosificación. - Restricciones alimentarias. - Efectos adversos. - Interacciones farmacológicas. - Afectación del estilo de vida. |
| Factores asociados a problemas de apego en población infantil | |||
| - Cuidador/a primario: Estadios avanzados de la enfermedad (sida), falta de compromiso con su propia salud; fallecimiento de la madre, padre o cuidador primario; adicciones. - Falta de revelación del diagnóstico a la niña o niño acorde a la edad. - Transición a clínica de personas adultas, etapa de adolescencia per se, el miedo y negación del diagnóstico por parte de sus cuidadores/as o del o la adolescente. - Adicciones en adolescentes. - Cronicidad de la enfermedad. - Comorbilidades. - ARV: Formulaciones limitadas, sabor desagradable de soluciones, número de dosis a administrar, tamaño de las cápsulas. | |||
Tabla 24: Causas de incumplimiento y posibles estrategias de intervención para mejorar el apego
| Factores | Causas potenciales de incumplimiento | Intervenciones potencialmente eficaces |
| Sociales, económicos, educativos | - Falta de apoyo social o familiar. - Escasos recursos. - Bajo nivel educativo. | - Buscar alianzas con familiares y compañeras/os. - Conocer las necesidades socioeconómicas. - Acercar a las y los pacientes con organizaciones civiles o comunitarias. - Proveer educación médica a la persona con explicaciones claras, precisas y comprensibles. - Sensibilizar y concientizar a las comunidades sobre el estigma y la discriminación relacionados con el VIH. - Apoyar a mujeres para reivindicar sus derechos de salud sexual y reproductiva. - Identificación y atención de la violencia intrafamiliar. |
| Sistema asistencial | - Falta de recursos. - Atención masificada e impersonal. - Ausencia de coordinación entre diferentes servicios de apoyo a la asistencia. - Insuficiente capacitación al personal médico en TAR. - Falta de accesibilidad. - Falta de pericia para lograr una relación personal positiva entre médico/a y paciente. | - Procurar una asistencia continua y de fácil acceso. Personas asintomáticas, con CV persistentemente indetectable y sin factores de riesgo para baja adherencia pueden ser evaluados en intervalos de 3-4 meses para evaluación médica rutinaria y monitoreo de estudios paraclínicos. (BIII) - Formar un equipo multidisciplinario eficiente (personal médico, de psicología, de trabajo social, etc.) - Asegurar recursos materiales y humanos, suficientes y coordinados. - Educación médica continua. - Impartir entrenamiento sólido en TAR y en atención digna a las personas. - Plantear terapia directamente observada en determinadas circunstancias. - Información clara sobre su derecho a una salud sexual y reproductiva libre de prejuicios. |
| Relacionados con el tratamiento | - Efectos adversos, sabor desagradable, tamaño y número de tabletas y dosis diarias. - Falta de adaptabilidad a la vida rutinaria dela persona. - Falta de adaptación a las preferencias y necesidades de la persona. | - Simplificar el régimen terapéutico. - Individualizar el tratamiento. - Atender comorbilidades, preferencias, interacciones. - Adoptar técnicas especiales para la toma de la medicación. - Indagar acuciosamente la posibilidad de intolerancia a medicamentos. - Desarrollar mecanismos proactivos y de reacción temprana (v.gr. anticipación y manejo oportuno de efectos adversos). - Indagar sobre cambios hormonales (menopausia, cambios en la libido, uso de tratamientos hormonales). |
| Relacionados con la persona | - No aceptación o negación del diagnóstico. - Rechazo o desconfianza al tratamiento (creencias y actitudes). - Olvidos y barreras. - Insuficiente comprensión de la enfermedad y su tratamiento. - Insuficiente comprensión de los verdaderos riesgos y beneficios de la terapia. - Comorbilidad psiquiátrica. - Uso y abuso de drogas. | - Evaluar y mejorar la relación y la comunicación entre pacientes y profesionales de la salud. - Consensuar el plan terapéutico, haciendo partícipes a las y los pacientes de las decisiones. - Retroalimentar el buen cumplimiento compartiendo con la persona la mejora de los indicadores (carga viral y conteo de células CD4). - Informar detalladamente sobre riesgos y beneficios del tratamiento. - Asociar la toma de medicamentos con actividades cotidianas. - Adoptar técnicas especiales de ayuda para el cumplimiento (diarios de medicación, alarmas, mensajes electrónicos, etc.). - Proveer información detallada de las consecuencias médicas del incumplimiento. - Dar información verbal y escrita. - Verificar la correcta comprensión de los mensajes médicos. - Alargar el tiempo de la consulta. - Buscar y ofrecer esquemas de ARV alternativos, en caso de intolerancia. - Derivar para intervención profesional especializada si se detecta patología psiquiátrica. |
| En menores de edad* | - Prescribir el menor número de dosis posibles, adecuar la toma de medicamentos al horario habitual de la niña o niño. - Simplificar los esquemas empleando coformulados de acuerdo con la edad, entrenamiento de deglución de tabletas a mayores de 5 años, adiestramiento al cuidador primario y al paciente acerca de la administración y almacenamiento de los medicamentos entre otros. - Iniciar la revelación del diagnóstico a partir de los 8 años de edad, de acuerdo con su desarrollo neurocognitivo e involucrarlo en forma activa en la toma de decisiones y recomendaciones durante la consulta. (BIII) - Es muy importante el seguimiento, sobre todo en los primeros meses de inicio del tratamiento antirretroviral. Durante el primer mes, evaluar a las personas más frecuentemente. | |
| *Se recomienda identificar al menos a dos personas como cuidadoras primarias en cada familia, dado que se requiere una persona disponible las 24 horas para el manejo de la niña o niño. En caso de que la persona que funge como cuidadora primaria principal no pueda realizar estas actividades, la segunda persona lo apoyará.(BII) | ||
2.8.2. Métodos para medir el apego
1. Los resultados de la carga viral, para mostrar un adecuado control de la viremia, pueden ser una documentación de un óptimo apego. Por el contrario, si los resultados son insatisfactorios, puede ser reflejo de mal cumplimiento, si bien puede obedecer a otros factores a pesar de un buen apego.
2. Se han utilizado cuestionarios estructurados de autoreporte o de aplicación interpersonal, métodos electrónicos, conteo de pastillas, surtido de recetas en farmacias y medición de los niveles plasmáticos del fármaco, ya sea programados o realizados aleatoriamente. Ninguno es un método idóneo, pues todos tienen algún tipo de inconveniente y deben elegirse y utilizarse en función de las condiciones propias del centro de atención.
3. El autoreporte o la entrevista interpersonal es de los métodos más utilizados y, por lo general, se correlaciona con la carga viral, pero tiende a sobreestimar el apego.
4. La apreciación que el propio personal médico tiene sobre el grado de adherencia de la persona es un instrumento limitado, al compararse con otras estrategias como la cuenta de tabletas, los reportes de movimientos en farmacia, etc. Algunas personas, con tal de complacer al médico o médica, sobreestiman su cumplimiento, e incluso llegan anegar la suspensión total de los medicamentos.
5. Es importante que las instituciones del Sistema Nacional de Salud que atienden a personas con VIH implanten acciones encaminadas a medir y favorecer el apego para garantizar la efectividad del tratamiento antirretroviral.
6. El personal médico de la Secretaría de Salud tiene acceso, a través del SALVAR, al instrumento para la medición del grado de apego elaborado por el Grupo de Ensayos Clínicos sobre sida (ACTG) de los Estados Unidos de América. Esta es una escala validada con el nivel de viremia y considerada como con una exactitud satisfactoria. El formato de este cuestionario está disponible en forma electrónica (incluyendo el algoritmo para obtener la calificación final) y tras la respuesta a ocho sencillas preguntas se obtiene de manera automática el porcentaje de adherencia al tratamiento.
7. Se recomienda medir sistemática y estructuradamente el grado de adherencia en cada consulta médica y, de manera obligatoria, cuando se documenta falla en el control viral.
8. En ocasiones, cuando la persona vive el conflicto de develar a su médica/o tratante el incumplimiento, es preferible que la medición del grado de adherencia lo realice algún otro profesional de la salud no involucrado en el cuidado de la persona.
Capítulo 3
3. Tratamiento antirretroviral en población infantil y adolescente
3.1. Criterios para iniciar el tratamiento antirretroviral
El tratamiento de la infección por VIH en pacientes pediátricos ha evolucionado desde 1986, año en el que se diagnosticó el primer caso pediátrico en nuestro país y el tratamiento estaba exclusivamente relacionado con las complicaciones, hasta la actualidad que incluye el tratamiento altamente activo con al menos tres medicamentos antirretrovirales, por consecuencia con resultados de mayor sobrevida, disminución de las infecciones oportunistas, adecuado desarrollo psicomotor y de la calidad de vida de nuestros pacientes pediátricos con VIH. Existe menor experiencia en el uso de los diferentes antirretrovirales por lo que es necesario considerar lo referido en la tabla 25 antes del inicio del tratamiento.
Tabla 25. Criterios para el inicio del tratamiento antirretroviral pediátrico
| Acciones a realizar | ||
| 1 | Identificar | A las personas responsables del cuidado del paciente. |
| 2 | Verificar | Presentación de los medicamentos para individualizar en cada paciente. |
| 3 | Capacitar e informar | Al cuidador primario sobre el tratamiento indicado y eventos adversos. |
| 4 | Involucrar | A los pacientes con su tratamiento mediante el manejo de información de acuerdo a la edad. |
| 5 | Determinar | El conteo total/porcentaje de linfocitos CD4, así como carga viral en todas las personas con VIH. |
Después de considerar los puntos anteriores, para valorar la gravedad y el riesgo de progresión de la enfermedad se tomará en consideración la edad de la niña o niño, su estadio clínico, CD4 y carga viral
(consultar tablas 26 y 27).
Tabla 26. Síntomas relacionados a VIH en pediatría*
| Categoría | Criterios |
| Sintomatología leve | Niñas o niños con dos o más de las siguientes condiciones, pero sin ninguna de las consideradas en la categoría moderada: - Linfadenopatías (=0.5 cm en más de dos sitios; bilateral en un sitio). - Hepatomegalia. - Esplenomegalia. - Dermatitis. - Parotiditis. - Infección respiratoria superior persistente o recurrente (sinusitis u otitis media). |
| Sintomatología moderada | - Anemia (Hb<8mg/dl), neutropenia (<1,000 células/mm3) o trombocitopenia (<100,000 células/mm3) que persisten más o igual a 30 días. - Un episodio de meningitis bacteriana, neumonía o sepsis. - Candidiasis orofaríngea, mayores de 6 meses, persiste >2 meses. - Miocardiopatía. - Infección por CMV que inicia <1 mes de edad. - Diarrea recurrente o crónica. - Hepatitis. - Estomatitis recurrente por virus del herpes simple (VHS), más de dos episodios en un año. - Bronquitis, neumonitis o esofagitis por VHS de inicio antes del primer mes de edad. - Herpes zoster que incluye más de un dermatoma o dos, o más episodios. - Leiomiosarcoma. - Neumonía intersticial linfoidea o complejo de hiperplasia linfoidea pulmonar. - Nefropatía. - Nocardiosis. - Fiebre de al menos un mes. - Toxoplasmosis que inicia antes de un mes de edad. - Varicela complicada o diseminada. |
| Estadio 3 Enfermedades oportunistas definitorias de SIDA | - Infección bacteriana grave, múltiple o recurrente (en niños <6 años). - Candidiasis esofágica o pulmonar (bronquio, tráquea, pulmones). - Cáncer cervical invasivo (= 6 años). - Coccidioidomicosis diseminada o extrapulmonar. - Criptococosis extrapulmonar. - Criptosporidiosis o isosporidiosis, crónica intestinal que persista por más de un mes. - Enfermedad por CMV que inicia después del primer mes de vida, en un sitio diferente del bazo, hígado o ganglios linfáticos. - Retinitis por CMV (con pérdida de la visión). - Encefalopatía atribuible a VIH. - Infección por VHS con úlceras mucocutáneas que persistan más de un mes, o bronquitis, neumonitis o esofagitis en niñas o niños mayores de un mes de edad. - Histoplasmosis diseminada o extrapulmonar. - Sarcoma de Kaposi. - Linfoma primario en el cerebro. - Linfoma de Burkitt, inmunoblástico o de células grandes, de células B o de fenotipo inmunológico desconocido. - Mycobacterium tuberculosis en cualquier sitio, pulmonar, diseminado o extrapulmonar. - Mycobacterium, otras especies o especies no identificadas, diseminadas o extrapulmonares. - Complejo Mycobacterium avium o Mycobacterium kansaii, diseminada o extrapulmonar. - Neumonía por Pneumocystis jirovecii. - Neumonía recurrente (>6 años) - Leucoencefalopatía multifocal progresiva. - Septicemia por Salmonella, recurrente. - Toxoplasmosis cerebral en mayores de un mes de edad. - Síndrome de desgaste atribuible a VIH. |
| *Panel on Antiretroviral Therapy and Medical Management of HIV-Infected Children. Guidelines for the Use of Antiretroviral Agents in Pediatric HIV Infection. Diagnosis of HIV infection in infants and children. March 5, 2015, C1-C10. | |
Tabla 27. Categorías inmunológicas en pacientes pediátricos basadas en linfocitos CD4*
| Categorías inmunológicas | <1 año | 1 a<6años | > 6 años | ||||
| células/ml | % | células/ml | % | células/ml | % | ||
| 1 | Sin evidencia de supresión | >1,500 | >34 | >1,000 | >30 | >500 | >26 |
| 2 | Supresión moderada | 750 a 1,499 | 26 a 33 | 500 a 999 | 22 a 29 | 200 a 499 | 14 a 25 |
| 3 | Supresión grave | <750 | <26 | <500 | <22 | <200 | <14 |
| Actualmente se considera de mayor valor pronóstico la cuenta total de CD4 que el porcentaje, independientemente de la edad. U.S Department of Health and Human Services, CDC. Revised Surveillance Case Definition for HIV Infection, United States. MMWR 2014; 63:1-11 | |||||||
3.2. Objetivos del tratamiento ARV
· Clínicos:
o Disminuir la morbilidad y mortalidad relacionada con el VIH.
o Mejorar la calidad de vida (disminuir o evitar las hospitalizaciones, disminuir las infecciones
oportunistas y otras complicaciones de infección por VIH, mejorar o mantener el desarrollo físico y la función neurocognitiva).
· Inmunológicos:
o Preservar y restaurar el sistema inmune (incremento de linfocitos CD4).
· Virológico:
o Lo ideal es lograr una carga viral indetectable.
3.3. Criterios de inicio del esquema ARV
Se reportan algunas diferencias entre población adulta e infantil que son importantes al considerar el inicio del esquema ARV, como por ejemplo: se puede identificar el momento de la infección (la mayoría es por vía perinatal), la progresión de la enfermedad es más rápida en niñas o niños que en personas adultas y los parámetros de laboratorio son menos predictivos del riesgo de la enfermedad (principalmente en niñas y niños pequeños).
El grupo de consenso de pediatría recomienda el inicio de TAR en todos los niños, niñas y adolescentes que viven con VIH independientemente de su condición clínica, cuenta de CD4 o conteo de carga viral basándose en el estudio START realizado en personas adultas. Dado que no existen estudios aleatorizados que comparen la eficacia de diferir contra iniciar tratamiento en niñas y niños sin inmunosupresión. La fuerza de la recomendación del inicio de tratamiento dependerá de la edad y de las características clínicas e inmunológicas del o la paciente. El inicio del tratamiento debe ser lo antes posible luego del diagnóstico.
Se recomienda priorizar el inicio del TAR en ciertos grupos de población como se puede consultar en la tabla 30. Previamente se recomendaba iniciar el TAR en el grupo entre 1 a 5 años de edad basándose en las guías de la OMS y en que hay un porcentaje pequeño de personas en los cuales, al diferirse el tratamiento, tienen pérdida del seguimiento y empeora el pronóstico. (BIII)
En ocasiones se difiere el tratamiento a solicitud del responsable de la niña o niño por alguna circunstancia clínica o por algún problema familiar o psicológico, lo cual debe resolverse lo más pronto posible. (Tabla 28)
Tabla 28. Causas de diferimiento del inicio de TAR en niñas y niños
| · Rechazo al diagnóstico y al manejo antiretroviral |
| · Problemas de dinámica familiar que no garanticen la adherencia al TAR |
| · Ausencia de cuidador primario |
Para los pacientes a quienes se difirió el tratamiento por cualquier circunstancia es imprescindible un seguimiento clínico, determinar las células CD4 y la carga viral cada tres o cuatro meses, e iniciar tratamiento inmediatamente si se detecta alguno de los tres parámetros siguientes: (Tabla 29)
Tabla 29. Recomendaciones de inicio de TAR (en caso de que se haya diferido el tratamiento)
| En cualquiera de las siguientes circunstancias: |
| · Disminución de linfocitos CD4+ |
| · Desarrollo de enfermedades oportunistas definitorias de estadio III |
| · Aumento de la carga viral |
En el caso de niñas o niños mayores a 6 semanas de edad con antecedente de madre con VIH, con sospecha clínica de infección por VIH (criterios del CDC, síntomas moderados o enfermedades oportunistas definitorias de estadio 3) y con una carga viral detectable, se recomienda iniciar el tratamiento lo más pronto posible y solicitar una segunda carga viral confirmatoria (CIII) (algoritmo 3). En caso de niñas o niños menores de 6 semanas, se recomienda interconsulta con personal con experiencia en VIH pediátrico.
Antes de comenzar el TAR se recomienda realizar dos determinaciones de CV (extracciones diferentes de sangre), sin embargo, puede iniciarse el tratamiento inmediatamente al tener el primer resultado positivo aun antes del mismo si el paciente tiene síntomas de enfermedad grave. Lo ideal sería que no estuviera cursando con un proceso infeccioso agudo y sin aplicación de vacunas en el último mes cuando se realice la CV.
Asimismo, es necesario realizar determinación de CD4 antes del inicio del TAR. El tratamiento de elección incluye al menos tres ARV, de por lo menos dos clases: 2 INTR + IP o INNTR o II.
Tabla 30. Recomendaciones para el inicio de TAR en niñas y niños
| Iniciar TAR | Priorizar | Se podría diferir (ver tabla 28) |
| A todos, (AI) independientemente de síntomas, estado inmune o carga viral | < 12 meses (AII) | · Asintomáticos o síntomas leves (BIII) y · Sin inmunosupresión (BIII) |
| Enfermedades oportunistas definitorias de Estadio 3 (AI) | ||
| Inmunosupresión Categoría 3 (AI) |
3.4. Esquema de tratamiento inicial en pediatría
Al igual que en los adultos, el TAR está recomendado en todo niño, niña y adolescente que viven con VIH, independientemente de la cuenta de CD4, CV y presencia o no de síntomas (<24 meses, (AII) >2-19 años (BI) debido a que ofrece mayores probabilidades de preservar o restaurar la función inmune y de retardar la progresión de la enfermedad. Esto derivado de estudios de adultos en quien han mostrado precisamente menor progresión de la enfermedad. El tratamiento de elección incluye tres ARV de dos diferentes grupos.
Existe poca información sobre farmacocinética de la mayoría de los IP, INNTR e II, principalmente para las y los menores de 3 años de edad. Con base en esta escasa información, se sugiere iniciar con alguna de las combinaciones descritas en la tabla 31.
El ensayo clínico 1060 presentó datos comparando NVP vs. LPV/r en lactantes de 2 a 36 meses de edad, se demostró superioridad de LPV/r sobre NVP con respecto a falla virológica/muerte y descontinuación del medicamento a las 24 semanas. Los resultados de incremento de CD4 y crecimiento fueron mayores para el grupo de NVP. (AII)
En niños > 3 años el INNTR de elección es EFV, sin embargo, debe tomarse en cuenta la adherencia al tratamiento, dado que tiene una barrera genética baja y además, la formulación en tabletas no es la óptima para niñas y niños menores de 40 kg.
En estudios realizados en niños pequeños, el efavirenz en combinación con 2 INTR o con un INTR y un IP ha mostrado resultados comparables a los de la población adulta (BII). Sin embargo, en las y los menores de tres años la farmacocinética no ha sido establecida completamente, por lo que se recomienda a esta edad solamente en situaciones especiales.
La combinación de INTR con mayor experiencia en pediatría es ZDV+3TC, sin embargo, un estudio comparativo y aleatorizado entre esta última combinación y ABC+3TC, demostró un mayor porcentaje de pacientes con CV bajo límite de detección, en pacientes que recibieron la combinación ABC+3TC. Por otra parte, una ventaja de esta última combinación es la potencial administración una sola vez al día, cuando la CV haya estado bajo límite de detección por más de seis meses. Es recomendable la determinación del HLA-B5701 antes del inicio de abacavir.
Se recomienda administrar los ARV en la presentación pediátrica indicada de acuerdo con la edad. En las tablas 31 y 32 se pueden consultar los esquemas recomendados para el TAR inicial en niños y niñas, y los fármacos ARV aprobados para uso pediátrico, sus presentaciones, dosis recomendadas y efectos secundarios más comunes.
Tabla 31. Esquemas recomendados para iniciar TAR en niñas y niños con VIH
| RN hasta < 14 días | Preferido NVP + 2 INTR | |
| Alternativo RALa + 2 INTR | ||
| > 14 días a < 3 años | Preferido LPV/r (AI) + 2 INTRb | |
| Alternativoa,b NVP + 2 INTR (en caso de no tolerar LPV/rb y sin exposición materna a profilaxis con NVP, o recién nacida/o con profilaxis a la misma) (BII) RAL (AII)a + 2 INTR | ||
| >3 años a < 12 añosf | 1 IP/r + 2 INTR | Preferido LPV/r (AI) ATV/r (BII) > 3 años |
| Alternativo Etanolato de Darunavir/r (AI) en dos dosis al día, >12 años y 40 kg. | ||
| 1 INNTR + 2 INTR | Preferido EFVc + 2 INTR (AI) | |
| 1 II + 2 INTR | Alternativo RAL (AII)c DTG (AI) en > 6 años y > 30 kg d EVG coformulado , > 12 años y > 35 kge | |
| Esqueleto (backbone) | INTR | Preferido ZDV + XTC(AI), desde RN a 6 años ABC + XTC(AI) > 3 meses TDF + XTC > 12 años con Tanner III (BII) y IV o V(AI) Alternativo TDF + XTC, >2 años y adolescentes Tanner 1 o 2 con resistencia a otros INTR, coinfecciones VHB, o en aquéllos que se desee una dosis al día y ABC no sea una opción. ZDV + ABC (> 3 meses) |
| Esquemas NO recomendados | NVP en adolescentes con CD4 >250 | |
| LPV: lopinavir; r: ritonavir; INTR: inhibidor nucleósido de la transcriptasa reversa; NVP: nevirapina; IP: inhibidor de proteasa; ABC: abacavir; 3TC: lamivudina; FTC: Emtricitabina; ATV: atazanavir; INNTR: inhibidor no nucleósido de la transcriptasa reversa; EFV: efavirenz; ZDV: zidovudina; II: inhibidor de integrasa; TDF: tenofovir disoproxil fumarato, XTC: emtricitabina o lamivudina. aRAL + 2 ITRAN, a partir de 2 semanas de edad, siempre y cuando se cuente con la presentación adecuada a cada grupo de edad (granulado hasta los 2 años, tabletas masticables en >2 años, en pacientes con capacidad de deglutir tabletas de 400 mg (>25 kg) o tuberculosis, hiperlipidemias, hijos de madres experimentadas a ARVs con sospecha o resistencia confirmada a LPV/r o INNTR. b >2 semanas (posnatal) y > 42 semanas de edad gestacional cDe preferencia con genotipo de resistencia basal. d Coformulación de ABC/DTG/3TC puede indicarse en >30 kg e EVG/COBI/FTC/TAF f Pacientes mayores de 12 años y con Tanner 4 o 5 referirse a la tabla de tratamiento de adultos, Darunavir o Etanolato de Darunavir, RAL,EVG, DTG requieren autorización por los comités correspondientes. |
Tabla 32. ARV utilizados en el tratamiento de niñas y niños con infección por VIH
| Nombre | Presentaciones | Dosis | Observaciones | |
| Zidovudina (ZDV) | Solución: 50mg/5ml Cápsula: 250mg Solución IV: 200mg/100 ml | - RN<35 SDG: 2mg/kg/12 h VO por 2 semanas después 3mg/kg/ 12h VO por 4 semanas. - RN de término ž VO: 4mg/kg/12h ž IV: 3mg/kg/12h - Niñas/os (6 semanas a 18 años): 240mg/m2SC/dosis c/12 h VO - Adolescentes: 250mg c/12h o 300 mg c/12h en presentación coformulada con 3TC | Anemia, granulocitopenia, miopatía, hepatotoxicidad. D** Ganciclovir, TMP/SMZ, Interferón-alfa, Aciclovir, Fluconazol, Ácido Valproico, DFH, Cimetidina, Rifampicina, Rifabutina, Ribavirina. iPuede ser tomada con alimentos, debe ajustarse en falla renal y hepática. | |
| Didanosina (ddI) | Tableta: 250, 400mg | - RN < 90 días: 50mg/m2SC/dosis c/12 h VO - Niñas/os: 90-120mg/m2SC/dosis c/12 h VO (límites: 90-150 mg) - Adolescentes: ž > 60 kg: 400 mgc/24 h ž < 60 kg: 250 mg c/24 h | Vómito, diarrea, dolor abdominal, neuropatía periférica, hiperuricemia, hepatitis, pancreatitis. DDelavirdina, IP iEn ayuno, una hora antes o dos horas después de los alimentos *** | |
| Lamivudina (3TC) | Solución: 10mg/ml Tableta: 150mg | - RN <30 días: 2 mg/kg/dosis c/12 h VO - Niñas/os: 4 5 mg/kg/dosis c/12 h VO - Niñas/os Tabletas: - 14kg - <20kg ½ tab C/12 h VO (total 150mg) - >20kg - <25kg ½ tab mañana y 1 tab noche VO (total 225 mg) - >25 kg 1 tab C/12 h VO (total 300 mg) - Adolescentes: ž > 50 kg: 150mg c/12 h VO ž < 50 kg: 4mg/kg/dosis c/12 h VO máx. 150 mg | Diarrea, vómito, exantema, neuropatía periférica, pancreatitis, hepatitis, neutropenia. D TMP/SMZ. i Puede darse con alimentos, ajustar en falla renal. | |
| Abacavir (ABC) | Solución: 20mg/ml Tableta: 300 mg | - Niñas/os >3 meses: 8 mg/kg/dosis c/12 h - Niñas/os tabletas: - 14kg - <20kg ½ tab c/12 h VO (total 300mg) - >20kg -<25 kg ½ tab mañana y 1 tab noche VO (total 450 mg) - > 25 kg 1 tab C/12h VO (total 600 mg) - Adolescentes: máximo 300 mg c/12 h o 600 mg c/24 h VO | Fatiga, vómito, hipersensibilidad (Determinar alelo HLA B 5701), fiebre. D No significativas. i Puede darse con alimentos, vigilar en pacientes con falla hepática. | |
| Emtricitabina (FTC) | Solución: 10 mg/ml Cápsula: 200 mg | - Niñas/os de 0 - < 3 meses: ž 3 mg/kg VO cada 24 h - Niñas/os >3 meses: ž <33 kg: Sol. 6 mg/kg/dosis c/24 h VO (máx. 240 mg) ž >33 kg: cápsula 200 mgc/24 h VO | Cefalea, diarrea, náusea, exantema, hiperpigmentación, neutropenia y acidosis láctica. D No significativas. i Puede darse con alimentos. | |
| Tenofovir disoproxil fumarato (TDF) | Tableta: 300 mg | - 2 a 12 años: 8 mg/kg/dosis c/24 h VO - Niñas/os >12 años: 300 mg c/24 h VO | Nausea, diarrea, vómito. Toxicidad ósea como osteomalacia, disminución de densidad mineral y alteraciones renales como calciuria, proteinuria, glucosuria, fosfaturia. Acidosis láctica. | |
| Tenofovir alafenamida (TAF) | Tabletas TAF 25 mg/Emtricitabina 200 mg | - > 12 años y > 35 kg de peso: ž 1 tab cada 24 VO | Astenia, cefalea, diarrea, nausea, aumento de lípidos séricos, contraindicado en insuf. renal (depuración < 30ml/minuto) |
| Efavirenz (EFV) | Tableta: 600 mg | - Niñas/os >3 años: ž 10 a <15 kg: 200 mg/kg/24 h VO ž 15 a <20 kg: 250 mg/kg/24 h VO ž 20 a <25 kg: 300 mg/kg/24 h VO ž 25 a <32.5 kg: 350 mg/kg/24 h VO ž 32.5 a <40 kg: 400 mg/kg/24 h VO - >40 kg: 600 mg/kg/24 h VO | Exantema. A nivel de SNC: vértigo, somnolencia, sueño anormal, psicosis. Potencialmente teratogénico no se recomienda en el 1er. Trimestre del embarazo. |
| Nevirapina (NVP) | Suspensión: 10 mg/ml Tableta: 200 mg | - Recién nacidos < 2 semanas, profilaxis: (consultar tabla 45 y 46) Tratamiento: - Niñas/os > 1 mes a <8 años: 200 mg/m2SC dosis VO c/12 h (máx. 200 mg) - Niñas/os >8 años: 120150 mg/m2SC dosis VO c/12 h (máx. 200 mg) | Exantema, Hepatitis, incluyendo necrosis hepática, hipersensibilidad con falla multisistémica. i Iniciar una dosis al día por dos semanas y posteriormente incrementar a dos dosis al día. |
| Etravirina (ETR) | Tableta: 100 mg, 200 mg | - Niñas/os >6 años y adolescentes: ž 16 a <20 kg: 100 mg c/12 h VO ž 20 a <25 kg: 125 mg c/12 h VO ž 25 a <30 kg: 150 mg c/12 h VO - >30 kg: 200 mg c/12 h VO | Exantema, reacciones de hipersensibilidad con falla hepática. iAdministrar después de las comidas. |
| Ritonavir (RTV) | Solución: 80 mg/ml TAB: 100 mg | - RN: En estudio (ACTG 354). Se recomienda coformulado con Lopinavir a partir de los 14 días de vida. - Adolescentes: 100 mg c/12 o 24h VO dependiendo del IP con el que se utilice. | Cefalea, vómito, diarrea, dolor abdominal, parestesias, hepatitis, sangrados, pancreatitis, hiperglicemia. D Induce citocromo P450 3A4, Meperidina, Diazepán, Aztemizol, Cisaprida, Triazolam, Midazolam, Rifampicina, Rifabutina, Estradiol, Carbamacepina, Fenobarbital, Dexametasona, DFH, Digoxina, NFV, SQV. i Con alimentos, separar 2 h de ddI, refrigerar (2º-8º). |
| Lopinavir /ritonavir (LPV/r) | Solución: LPV/r 80/20 mg/ml Tableta: LPV/r 200/50 mg Tableta pediátrica: LPV/r 100/25 mg | - RN: Se recomienda coformulado a partir de los 14 días de vida. - Niñas/os > 14 días 12 meses - 300 mg/75 mg/m2 SC/dosis c/12 h VO o 16mg/4 mg/kg dosis c/12 h VO - Niñas/os > 12 meses a 18 años - 300 mg /75 mg/m2 SC/dosis c/12 h (máximo 400/100 mg c/12h) - Niñas/os > 12 meses a 18 años - <15kg: 13 mg/3.25 mg/kg/dosis c/12 h VO - >15kg 45 kg: 11mg/2.75 mg/kg/dosis c/12 h VO - Adolescentes: LPV/r 400/100 mg c/12 h VO | Diarrea, cefalalgia, astenia, náusea y vómito. Incremento de triglicéridos y colesterol sérico, exantema. Son raros: Sangrado en hemofílicos, pancreatitis, hiperglicemia, cetoacidosis, diabetes y hepatitis. DNo administrar con antiarrítmicos, antihistamínicos, Cisaprida, Midazolam, Rifampicina; anticonvulsivos, Dexametasona, Claritromicina, Rifabutina, Ketoconazol, etc. i Con alimentos, las grasas aumentan su absorción. Dar 1 h antes o 2 h después de ddI. Refrigerar (2-8º). |
| Atazanavir (ATV) | Cápsula: 300 mg | - Niñas/os > 6 años y > 15kg - > 15 kg < 20 kg: 150 mg + 100 mg ritonavir c/24 h VO - 20 kg < 40kg: 200 mg + 100 mg ritonavir c/24 h VO - > 40kg: 300 mg + 100 mg ritonavir c/24 h VO | Hiperbilirrubinemia indirecta, nefrolitiasis, hiperglicemia i Administrar con alimentos |
| Etanolato de Darunavir* | Comprimido: 75, 150, 400 y 600 m | - Niñas/os > 3 años y > 10 kg: - 10kg <11kg: 200mg + 32mg ritonavir c/12h VO - 11kg <12kg: 220mg + 32mg ritonavir c/12h VO - 12kg <13kg: 240mg + 40mg ritonavir c/12h VO - 13kg <14kg: 260mg + 40mg ritonavir c/12h VO - 14kg <15kg: 280mg + 48mg ritonavir c/12h VO - 15kg <30kg: 375mg + 48mg ritonavir c/12h VO - 30kg <40kg: 450mg + 100mg ritonavir c/12h VO - >40 kg: 600 mg + 100mg ritonavir c/12h VO - >12 años y >40 kg: Se puede utilizar 800 mg + 100 mg ritonavir c/24 h | Exantema, nausea, diarrea, cefalea, hepatotoxicidad, hiperlipidemia. |
| Raltegravir (RAL) | Tableta: Suspensión 20 mg/ml, 100 mg (masticables), 400 mg | - Niñas/os >2 años a 12 años: ž 11 a 14 kg: 75 mg c/12 h VO ž 14-20 kg dar100 mg c/12 h VO ž 20-28 kg dar 150 mg c/12 h VO ž 28-40 kg dar 200 mg c/12 h VO ž >40 kg dar 300 mg c/kg 12 h VO - En mayores de 12 años o >25kg 400 mg c/12 h VO | Nausea y cefalea, diarrea y fatiga, en ocasiones dolor abdominal. |
| Dolutegravir (DTG) | Tableta: 10 mg, 25 mg, 50 mg | - >6 años y >30 kg: 35 mg C/24 h VO - >12 años y 40 kg: 50 mg una vez al día; si se combina con EFV o Rifampicina 50 mg c/12 h VO. | Cefalea, insomnio e hipersensibilidad |
| Enfuvirtida (T20) | Ámpula: 90 mg | - >6 años: 2 mg/kg/dosis c/12 h (máxima dosis de 90 mg por dosis) SC | Reacciones locales, aumento de tasa de neumonías bacterianas e hipersensibilidad |
| Maraviroc (MVC) | Tableta: 150 y 300 mg | - Niñas/os > 2 años y peso > 10 kg: - 10kg <20kg: 50 mg c/12h VO - 20kg <30kg: 75 mg c/12h VO - 30kg <40 kg: 100 mg c/12h VO - >40 kg: 150mg c/12h VO | Dolor abdominal, tos, hepatotoxicidad e hipotensión ortostática. iRequiere prueba de tropismo CCR5 |
| : toxicidad; D: interacciones; i: instrucciones *Las recomendaciones de uso en niños son exclusiva para formulaciones con Etanolato de Darunavir ya que es la única molécula con estudios de seguridad para su uso en mujeres embarazadas y niños. FTC: Emtricitabina; TDF: tenofovir disoproxil fumarato; TAF: Tenofovir alafenamida; EFV: efavirenz; NVP: nevirapina; ETR: Etravirina; RTV: Ritonavir; LPV: lopinavir; r: ritonavir; ATV: atazanavir; RAL: Raltegravir; DTG: Dolutegravir; T20: Enfuvirtida; MVC: Maraviroc; DFH: Difenilhidantoína; NFV:Nelfinavir; SQV:Saquinavir. | |||
Tabla 33. ARV coformulados para adolescentes con VIH
| Nombre | Presentaciones | Dosis | Observaciones | |
| Abacavir (ABC) | Abacavir 600mg/ lamivudina 300mg (ABC/3TC) | Adolescentes >25 kg: 1 tab c/24h | i No usar estas presentaciones en pacientes con daño hepático debido a que la dosis de abacavir no se puede ajustar ni en pacientes con depuración de Cr <50 mL/min y en pacientes con diálisis (debido a la dosis fija de lamivudina). | |
| Abacavir 300mg/ lamivudina 150mg/ zidovudina 300mg (ABC/3TC/ZDV) | Adolescentes >40 kg: 1 tab c/12h | |||
| Abacavir 600mg/dolutegravir 50mg/lamivudina 300mg (ABC/3TC/DTG) | Adolescentes >40 kg: 1 tab c/24h | |||
| Lamivudina (3TC) | Lamivudina/zidovudina 300mg/150 mg (ZDV/3TC) Ver abacavir | Adolescentes: 1 tab c/12h | Anemia, granulocitopenia, miopatía, hepatotoxicidad. D** Ganciclovir, TMP/SMZ, Interferón-alfa, Aciclovir, Fluconazol, Ácido Valproico, DFH, Cimetidina, Rifampicina, Rifabutina, Ribavirina. iPuede ser tomada con alimentos, debe ajustarse en falla renal y hepática. | |
| Emtricitabina (FTC) | Emtricitabina/tenofovir disoproxil fumarato 200 mg/300 mg (TDF/FTC) | Adolescentes >35 kg: 1 tab c/24h | i No utilizar FTC/TDF/EFV en pacientes con depuración de Cr <50 mL/min y en pacientes con diálisis. | |
| Emtricitabina/tenofovir alafenamida 200mg/25mg (TAF/FTC) | Adolescentes >25 kg: 1 tab c/24h | |||
| Emtricitabina/tenofovir disoproxil fumarato/emtricitabina 200mg/300mg/600 mg (TDF/FTC/EFV) | Adolescentes >40 kg: 1 tab c/24h | |||
| Elvitegravir (EVG) | Elvitegravir 150mg/tenofovir alafenamida 10mg/emtricitabina 200mg/cobicistat 150mg (EVG/c/TAF/FTC) | Adolescentes >12 años y >35 kg: 1 tab c/24 h VO | Diarrea, flatulencia, nausea, vomito, cefalea, fatiga iAdministrarse con alimentos | |
| Etalonato de Darunavir* | Etanolato de Darunavir/cobi 800mg/150mg | Adolescentes >40 kg: 1 tab c/24h | Exantema, nausea, diarrea, cefalea, hepatotoxicidad, hiperlipidemia. | |
| : toxicidad; D: interacciones; i: instrucciones ABC: Abacavir; 3TC:Lamivudina; FTC:Emtricitabina; EVG:Elvitegravir; Cobi: cobicistat. *Las recomendaciones de uso de Darunavir en niños son exclusiva para formulaciones con Etanolato de Darunavir ya que es la única molécula con estudios de seguridad para su uso en mujeres embarazadas y niños. | ||||
3.5. Falla al tratamiento antirretroviral en población infantil y adolescente
3.5.1. Criterios de cambio de TAR por falla terapéutica en población infantil
Hay situaciones en las cuales el TAR inicial que está recibiendo un niño o niña presenta evidencia de falla o toxicidad. Ante esta situación, es importante considerar las siguientes recomendaciones para el cambio de TAR. Debe documentarse la falla lo más pronto posible debido a que el mismo esquema favorece el desarrollo de resistencia cruzada y disminuye la posibilidad de respuesta de un esquema de rescate.
Tabla 34. Criterios de falla al tratamiento antirretroviral
| Falla terapéutica | |
| Evidencia de progresión de la enfermedad basada en cualquiera de los siguientes parámetros virológicos, inmunológicos y/o clínicos. | |
| Falla virológica | · Dos cargas consecutivas por encima de 200 copias/mL a partir de los 6 meses de iniciado el TAR · No alcanzar niveles indetectables de CV no debe de ser criterio único para decidir cambio de tratamiento. |
| Falla inmunológica | · Respuesta inmunológica incompleta: es la incapacidad de mantener o alcanzar la cuenta o porcentaje de CD4 al menos por arriba de la categoría de inmunosupresión grave de acuerdo a la edad. · Declinación inmunológica durante el tratamiento: es la disminución sostenida > 5% de CD4 a cualquier edad o disminución de la cuenta de CD4 por debajo de la basal en niñas y niños mayores de 5 años. · Las niñas y niños con supresión inmunológica grave basal pueden demorar más de un año para obtener una recuperación en las cifras de células CD4+, en este caso pueden presentarse IO y deberán descartarse errores de laboratorio, comorbilidades, efectos adversos y otros factores que pudieran estar relacionados con el fallo inmunológico. · Los niños con falla inmunológica y con supresión virológica no se recomienda el cambio de TAR. |
| Falla clínica | · Se define como la aparición de nuevas infecciones oportunistas y/o la evidencia de progresión de la enfermedad durante el tratamiento. · En pacientes con control virológico e inmunológico, el desarrollo de síntomas clínicos no siempre obedece a una falla, en estos casos se deberá descartar la presencia de SIRI, principalmente en pacientes que acaban de iniciar el TAR. |
| Falla en el apego o adherencia al tratamiento | |
| Se define como falla en el apego aquella situación que el no tomar los medicamentos ARV condiciona una falla terapéutica (tabla 23). En estos casos, antes de considerar el cambio de tratamiento, deben emplearse todos los recursos disponibles para mejorar el apego: apoyo psicológico y social tanto a la niña o niño como a la familia (tabla 24). La probabilidad de falla en el apego a un segundo esquema en estos casos es muy alta. | |
| Falla por toxicidad | |
| Es aquella condición en la que la niña o niño presenta una de las siguientes situaciones: · Un evento o reacción a uno o varios de los medicamentos que pone en peligro la vida; por ejemplo: hepatitis o pancreatitis aguda, reacción anafiláctica. · Alteraciones en algunos estudios de laboratorio (entre los más comunes: anemia, neutropenia, plaquetopenia; elevación de las transaminasas, bilirrubinas y de los lípidos). · Cada caso se debe individualizar y establecer en lo posible la relación causa-efecto, así como el riesgo-beneficio del medicamento sospechoso. | |
3.5.2. Recomendaciones para modificar el tratamiento inicial
A. En caso de toxicidad o intolerancia a uno de los ARV:
1. Deben eliminarse del esquema aquellos ARV que se ha demostrado son los causantes de la intolerancia o toxicidad y ser sustituidos por ARV con perfil diferente de toxicidad.
B. En caso de falla terapéutica:
1. Carga viral >50 copias/ml a los 6 meses de TAR, se debe reforzar la adherencia a los medicamentos.
2. Investigar a fondo la posibilidad de falla en el apego como la causa del fracaso terapéutico e implementar estrategias de acuerdo a cada caso.
3. Valorar el historial de ARV.
4. Considerar las interacciones medicamentosas.
5. Deberá realizarse un ensayo de resistencia realizado durante la terapia en falla o máximo cuatro semanas después de haberla suspendido. Asimismo, se debe analizar la historia de
antirretrovirales y todos los genotipos previos.
6. El nuevo régimen debe incluir idealmente tres y por lo menos dos ARV completamente activos y que no estén incluidos en el esquema anterior.
7. El esquema debe incluir mínimo tres ARV de dos grupos diferentes.
3.5.3. Esquemas de tratamiento por falla terapéutica en niñas y niños
Es importante enfatizar que las probabilidades de respuesta a largo plazo se reducen a partir del segundo esquema en caso de falla terapéutica. En el grupo pediátrico existe mayor riesgo de desarrollar resistencia a los ARV por varias razones:
· Las y los niños tienen CV más elevadas que las y los adultos, por lo que la respuesta al tratamiento es más lenta.
· Uso de algunas combinaciones de ARV con menor potencia.
· Errores de dosificación.
· Limitación en las formulaciones pediátricas.
· Dependencia de una persona adulta para la administración de los medicamentos.
· Adolescencia per se.
· Personal de salud con escasa experiencia en el manejo de este grupo de pacientes.
3.5.4. Consideraciones importantes para el cambio de tratamiento
El objetivo del tratamiento es lograr una CV plasmática indetectable de acuerdo con la técnica utilizada.
· Idealmente se deben cambiar los dos INTR, sin embargo, en caso de deterioro o afectación neurológica, cuando sea posible, continuar con ZDV por su buena penetración al sistema nervioso central, siendo otras posibilidades ABC, NVP, EFV, LPV/r y ATV/r.
· En caso de falla a un esquema inicial que contenía 3TC puede considerarse seguir empleando este fármaco ya que la presencia de la mutación M184V puede reducir la capacidad de replicación viral y puede inducir a un cierto grado de re-sensibilización a ZDV o TDF, aunque esto se basa en datos limitados en adultos. (BII)
· En caso de falla a un INNTR no debe utilizarse otro del mismo grupo, excepto etravirina que puede ser activo en presencia de un número limitado de mutaciones que confieren resistencia a NVP y/o EFV. (CII)
· En ocasiones es posible reintroducir medicamentos previamente suspendidos por intolerancia, siempre y cuando no exista resistencia (comprobado por genotipo). (CII)
· En caso de falla al tratamiento se recomienda consultar a un centro de atención especializada, y si se sospecha o se identifica multirresistencia derivarlo al mismo para su manejo.
Tabla 35. Esquemas recomendados en caso de falla terapéutica en pacientes pediátricos*
| Esquema previo | Cambio recomendado |
| 2 INTR + INNTR | · 2 INTR + IP/r · 2 INTR + II |
| 2 INTR + IP/r | · 2 INTR+1 INNTR · 2 INTR + 1 IP/r diferente** · 2 INTR + II |
| 2 INTR + II | · 2 INTR + IP/r Se requiere de valoración por el comité correspondiente |
| Esquemas que han fracasado que incluyan INTR+INNTR+IP/r | · Inhibidor de integrasa+2 INTR+/- IP/r (si los INTR no son completamente activos) · Realizar el esquema de II con la combinación de algunos de estos ARV: IP/r, ETV, INTR(s) (si permanecen con alguna actividad). · Considerar utilizar T20 y/o MVC. Se requiere de valoración por comité correspondiente |
| * Todos los esquemas deben evaluarse de acuerdo con los antecedentes de los antirretrovirales utilizados, y de acuerdo con resultados de genotipo ** Con base al genotipo, cambiar el IP a uno plenamente activo y de mayor barrera genética INTR: inhibidor nucleósido de la transcriptasa reversa; INNTR: inhibidor no nucleósido de la transcriptasa reversa; IP/r: inhibidor de proteasa potenciado con ritonavir; II: inhibidor de integrasa. | |
3.6. Esquemas recomendados en pacientes pediátricos con falla a múltiples antirretrovirales
Dado que la llave para el éxito de los esquemas en pacientes multitratados es el número de medicamentos activos, se debe de intentar contar con el mayor número de estos.
- Inhibidores de proteasa: Etalonato de Darunavir/r
- Inhibidores de transcriptasa reversa no nucleósidos: etravirina y rilpivirina
- Inhibidores de integrasa: raltegravir, dolutegravir
- Inhibidores de fusión: maraviroc, enfuvirtida
El manejo de ARV de las clases antes mencionadas en pacientes multitratados, será definido por cada institución.
Tabla 36. Consideraciones especiales en relación a ARV utilizados en niños multitratados
| · Tenofovir (TDF) se recomienda a partir de 12 años, entre 2 y 12 años es una alternativa de tratamiento y debe evitarse antes de los 2 años. · Etravirina en combinación con Etanolato de Darunavir/r es una opción efectiva para pacientes con falla al primer esquema. (AI) · Etanolato de Darunavir ha sido aprobado para su uso en niños mayores de 3 años. (AI) · Raltegravir, por su formulación en México se recomienda en niños mayores de 12 años o más de 25 kg · Maraviroc está aprobado en > 2 años y > 10 kg, previo ensayo de tropismo CCR5. La dosis varía de acuerdo al esquema de tratamiento. · Dolutegravir puede emplearse en pacientes mayores de 6 años que pesan >30kg. · La etravirina puede utilizarse a partir de los 6 años y > 16 kg, no se debe administrar con otros INNTR e IP no potenciados. Solo se puede administrar con DTG cuando se combina con IP potenciado. · Enfuvirtida se recomienda en > 6 años sin embargo como su administración es subcutánea la adherencia en niños y adolescentes es mala. |
3.7. Transición a clínicas de personas adultas
La transición es un proceso multifacético y activo que atiende las necesidades médicas, psicosociales, cognitivas y educacionales de los adolescentes a medida que avanzan desde el sistema de salud dirigido a niños al de los adultos.
No hay un modelo definitivo de transición, pero es cierto que este proceso merece especial atención y está considerado como un momento crítico en la atención de este grupo de pacientes, ya que existe un mayor riesgo de mortalidad y de pérdida de seguimiento después de la transición a las clínicas de adultos.
El cronograma a seguir para preparar a los y las adolescentes quedó plasmado en las guías inglesas CHIVA (Cambio de Apoyo: Transición Exitosa, siglas en inglés) y se muestra en la tabla 37 adaptado al escenario de México.
Tabla 37. Cronograma para plan de transición a clínicas de adultos.
Tareas del médico, adolescente y cuidador primario (AIII)
| Edad del adolescente | Médico | Adolescente | Cuidador |
| 11-13 años | Revelación del diagnóstico al paciente Información sobre: · Vías de transmisión · Manejo de presión de pares · Sexo seguro · Uso de condón · Anticoncepción · Revelación del diagnóstico a otros · Fertilidad · Embarazo · ITS | · Maneja el procedimiento para surtir medicamentos · Conocer el esquema ARV que recibe · Toma sus medicamentos por si solos · Saber referir signos y síntomas durante la consulta | · Apoyo familiar · Revelación del diagnóstico · Supervisar tareas del adolescente |
| 14-16 años | Información: · Adicciones · Confidencialidad · Estigma · Discriminación | · Conoce vías de transmisión · Tiene más responsabilidades durante la consulta. · Expectativas: estudios, trabajo | · Apoyo familiar · Comparte responsabilidades del adolescente |
| 17-19 años | Concretar la transición | · Conoce medidas preventivas. · Planes de vida independiente · Actividad sexual responsable y manejo de métodos de planificación familiar | · Apoyo familiar |
Adaptado de: CHIVA. Supporting Change: Successful Transition for Young People Who Have Grown Up with HIV Infection. Guidance for Practice. Disponible en: www.chiva.org/chiva (acceso junio 2008)
Algunos servicios establecen el momento de transición con base en la edad cronológica (17-18 años) e idealmente el adolescente debe encontrarse en las mejores condiciones clínicas y psicológicas.
Es necesario preparar un resumen con la información médica y de forma detallada la historia de ARV y CD4+, CV, laboratoriales, además de antecedentes perinatales, vacunación, comorbilidades, hospitalizaciones, entre otros. Es importante proporcionar una dotación de ARV suficientes (se sugiere para tres meses, esto puede variar dependiendo de cada caso). (AIII)
3.7.1. Recomendaciones para el proceso de transición
Una transición bien planificada le permite al adolescente optimizar su capacidad de asumir las funciones y actividades de los adultos y mejora los resultados de salud entre los adolescentes infectados por el VIH.
1. Se sugiere que los pediatras en colaboración con un médico de adulto con experiencia en la atención de este grupo de adolescentes elaboren un proceso formal para la transición.
2. El paciente y su familia deben recibir la información sobre el proceso de transición con anticipación. Los adolescentes deben ser revelados antes de iniciar el proceso.
3. Pasos clave en el proceso de transición:
a) El pediatra debe desarrollar un plan de transición por escrito y compartirlo con el personal, familia y paciente así mismo se debe establecer un sistema para realizar un seguimiento del proceso de transición.
b) La transición debe iniciarse con la información adecuada, incluyendo resumen médico completo. Una visita antes de la transferencia puede ayudar en el establecimiento de una relación exitosa a largo plazo.
c) La finalización de la transición debe ser documentada en el expediente, y el resultado del proceso debe ser evaluado. El equipo pediátrico deberá estar en comunicación con el de adultos como un recurso durante el periodo inmediato a la transición.
4. La atención de la salud de los adolescentes, se recomienda, evaluarse regularmente para garantizar la continuidad de la cobertura de atención a la salud y el acceso ininterrumpido a los medicamentos ARV.
Tabla 38. Criterios a cumplir para una transición exitosa
| La o el adolescente ha aceptado la cronicidad de su enfermedad y tiene un proyecto de vida. | ü |
| La o el adolescente ha aprendido las habilidades necesarias para negociar con diversos proveedores de salud. | ü |
| La o el adolescente ha logrado independencia personal y médica y es capaz de asumir la responsabilidad de su tratamiento y participar en la toma de decisiones. | ü |
| El médico(a) de la persona adolescente está familiarizado con su contraparte de atención a personas adultas que le dará seguimiento y hay comunicación directa sobre un plan individualizado para él o la paciente joven. | ü |
| Se atienden las necesidades psicosociales de adolescente y cuenta con vivienda, servicios de salud, transporte, etc. | ü |
| Se han abordado habilidades para la vida (ej. objetivos educativos, empleo, maternidad/paternidad) | ü |
| La o el adolescente recibe atención médica integral ininterrumpida. | ü |
Tabla 39. Herramientas para la transición a clínicas de personas adultas
| | 8 a 11 años de edad | 12 a 14 años de edad | 15 a 16 años de edad | ||||
| Discutido | Alcanzado | Discutido | Alcanzado | Discutido | Alcanzado | ||
| Conocimiento del diagnóstico y su manejo | |||||||
| Interactúa directamente con el equipo de salud y hace preguntas | | | | | | | |
| Preparación de la persona adolescente y su familia, y ayudarles con la revelación | | | | | | | |
| Es capaz de responder a la pregunta ¿Qué es el VIH? | | | | | | | |
| Es capaz de responder a la pregunta ¿Qué son las células T CD4? | | | | | | | |
| Es capaz de responder a la pregunta ¿Qué es la carga viral? | | | | | | | |
| Conoce el nombre y la dosis de sus medicamentos | | | | | | | |
| Verbaliza las indicaciones para tomar sus medicamentos (Ej., horarios, relación con alimentos) | | | | | | | |
| Es capaz de solicitar recetas y surtirlas | | | | | | | |
| Verbaliza posibles efectos secundarios de los medicamentos | | | | | | | |
| Es independiente para tomar sus medicamentos | | | | | | | |
| Es capaz de obtener una cita médica de manera independiente. | | | | | | | |
| Es capaz de dar su historial de manera independiente. | | | | | | | |
| Verbaliza cuándo y cómo llamar al médico. | | | | | | | |
| Verbaliza cuándo y cómo acudir al servicio de urgencias. | | | | | | | |
| Es capaz de tomar el transporte para asistir a su cita. | | | | | | | |
| Respeta el calendario de citas. | | | | | | | |
| Es capaz de identificar a las y los integrantes del equipo de atención de la salud, las funciones de cada una de estas personas y cómo ponerse en contacto con ellas. | | | | | | | |
| Promoción a la salud en adolescentes | |||||||
| Visita al dentista cada 6 meses. | | | | | | | |
| Vacunas al corriente. | | | | | | | |
| Conductas preventivas (ejercicio, nutrición, etc.). | | | | | | | |
| Se abstiene de consumir alcohol, tabaco, drogas. | | | | | | | |
| Adolescentes que demuestran conocimiento de actividad sexual responsable | |||||||
| Identifica situaciones de alto riesgo para explotación y victimización. | | | | | | | |
| Conoce métodos de anticoncepción, ITS y prevención de ITS. | | | | | | | |
| Comprende las consecuencias de un embarazo | | | | | | | |
Adaptado de: California Healthy and Ready to Work Transition Materials, 1 mcj d6hrw9-01-0, University of Southern California, Department of Nursing: www.cahrtw.org
Capítulo 4
4. Embarazo y VIH
El uso de los medicamentos ARV durante el embarazo, combinado con otras intervenciones como es el uso de medicamentos intraparto, la profilaxis al recién nacido, la resolución del embarazo vía cesárea y la eliminación de la lactancia materna en mujeres que viven con VIH, han logrado disminuir el riesgo de transmisión perinatal. Actualmente el riesgo de infección es de menos del 2% dando cumplimiento a estas recomendaciones.
Múltiples estudios observacionales avalan la eficacia y la seguridad del TAR en las mujeres embarazadas que viven con VIH, por lo que se recomienda la administración de terapia triple durante el embarazo. Se recomienda continuar la terapia antirretroviral después de la resolución del embarazo, de manera ininterrumpida, independientemente del conteo basal de células CD4.
Objetivo del tratamiento: Lograr la supresión viral y mantener la carga viral indetectable al momento del nacimiento para evitar la transmisión vertical y tener una madre viva y un niño sano. (AII)
4.1. Inicio del tratamiento antirretroviral
El TAR está indicado en todas las gestantes, independientemente del número de linfocitos CD4 y de la CV que presenten (A-I). No utilizar dolutegravir durante el embarazo.
En mujeres con diagnóstico de infección por VIH que se encuentran recibiendo TAR y con carga viral de VIH indetectable al momento de diagnosticar el embarazo, la recomendación actual es dar continuidad al esquema administrado y consejería sobre la importancia de continuar TAR más allá de la etapa perinatal. En caso de iniciar el TAR después de una prueba reactiva durante el trabajo de parto, se recomienda brindar consejería durante el puerperio sobre la importancia de la adherencia al tratamiento.
Para más información sobre la consejería para mujeres embarazadas con VIH se recomienda consultar la Guía de Salud Sexual y Reproductiva para Mujeres y VIH del Centro Nacional de Equidad y Género y Salud Reproductiva.
4.1.1. Factores a considerar cuando se selecciona un tratamiento de inicio
· Perfil de resistencia del virus.
· La seguridad y la eficacia de las drogas en la madre y el producto.
· El potencial de adherencia y tolerabilidad del régimen.
· Las interacciones potenciales con otros medicamentos.
· Información de farmacocinética durante el embarazo, considerando fármacos con distribución cervicovaginal
4.1.2. Evaluación y tratamiento
Una vez confirmado el diagnóstico, las mujeres embarazadas, deben recibir una evaluación integral inicial, de la misma forma que cualquier persona con VIH.
Tabla 40. Esquemas recomendados para inicio de TAR en mujeres embarazadas
| Eje de esquema | Tercer componente | |
| TDF/FTC2 | RAL (400 mg BID) | Esquema recomendado, en especial en mujeres embarazadas con más de 28 SDG |
| Esquema alternativo | ||
| ABC/3TC1 o TDF/FTC2 | Etanolato de Darunavir + r (600 + 100 mg BID) o LPV/r4 | Se recomienda el ajuste a la dosis estándar inmediatamente después de la resolución del embarazo. |
| ABC/3TC1 | RAL (400 mg BID) | No se ha demostrado que la respuesta viral de la combinación de RAL+ABC/3TC sea igual que con TDF/FTC en pacientes con más de 100,000 copias/ml. |
| 1 Realizar HLA-B5701 e iniciar tratamiento tan pronto como se disponga del resultado. 2 Sin contraindicación por potencial de toxicidad renal. Hay estudios en humanos que no han mostrado efectos en el crecimiento intrauterino (peso, talla, longitud de fémur) pero que concluyen que aún se requiere mayor experiencia; hay conflicto sobre efectos potenciales en el crecimiento durante la infancia. 4 LPV/r (aumentar la dosis habitual a 600/150 mg BID a partir de las 24 SDG), iniciar solo en caso de no contar con RAL o Darunavir o Etanolato de Darunavir + r para inicio de forma inmediata *Las recomendaciones de uso de Darunavir en embarazadas son exclusiva para formulaciones con Etanolato de Darunavir ya que es la única molécula con estudios de seguridad para su uso en mujeres embarazadas y niños 3TC: lamivudina; r: ritonavir; ABC: abacavir; TDF: tenofovir disoproxil fumarato; FTC: emtricitabina; RAL: raltegravir; SDG: semanas de gestación; r: ritonavir. | ||
Tabla 41. Observaciones de los fármacos utilizados en esquemas de inicio en el embarazo
| Medicamento | Observaciones | |
| Eje del esquema antirretroviral | ||
| ABC/3TC | Cuando esté contraindicado TDF (BIII). Eje no recomendado en caso de coinfección con Hepatitis B. | |
| Tercer componente | ||
| ATV+r | Este ARV no fue incluido en las recomendaciones de inicio por la dificultad de acceso nacional a la presentación de 200 mg | |
| LPV/r | LPV/r (aumentar la dosis habitual a 600/150 mg BID a partir de las 24 SDG), iniciar solo en caso de no contar con RAL o Etanolato de Darunavir + r para inicio inmediato | |
| Etalonato de Darunavir+r | IP recomendado y en caso de falla al control viral Dosis recomendada 600mg + ritonavir 100mg cada 12h | |
| EFV | No nucleósido preferido cuando haya inconveniente con el uso de los IP y de los inhibidores de integrasa. No contraindicado en embarazo, ya que el riesgo relativo de defectos al nacimiento es igual en productos expuestos vs. no expuestos (AII). En casos de coinfección con tuberculosis. | |
| EVG/c | No está recomendado su uso en embarazo, por lo que no deberá iniciarse como esquema de tratamiento en esta condición | |
| DTG | Considerar riesgo potencial de alteraciones en el tubo neural si se usa durante el embarazo. Evitar su uso en mujer con potencial de embarazo y sin un método adecuado de anticoncepción. | |
| TDF: tenofovir disoproxil fumarato; FTC: Emtricitabina; ZDV: zidovudina; ABC: abacavir; 3TC: lamivudina; ATV: atazanavir; r: ritonavir; LPV: lopinavir; INNTR: inhibidor nucleósido de la transcriptasa reversa; EFV: Efavirenz; IP: inhibidor de proteasa; NVP: nevirapina; RAL: raltegravir. *Las recomendaciones de uso de Darunavir en embarazadas son exclusiva para formulaciones con Etanolato de Darunavir ya que es la única molécula con estudios de seguridad para su uso en mujeres embarazadas y niños. | ||
Tabla 42. Terapia antirretroviral en mujeres embarazadas con tratamiento previo
| Embarazada con tratamiento previo | Recomendaciones* |
| Con CV < 50 copias/ml | · Continuar mismo esquema. (AII) · En caso de haber estado en tratamiento con EFV, se deberá continuar el mismo esquema. · En caso de estar en tratamiento con DTG y embarazo menor a 8 SDG cambiar a RAL · En caso de estar en tratamiento con TDF/FTC/EVG/c, cambiar a TDF/FTC+RAL durante el embarazo |
| Abandono a tratamiento previo, tratamiento con interrupciones intermitentes o en falla virológica o VSA con pareja VIH en falla virológica | · Iniciar tratamiento acorde al genotipo e historial de tratamientos, de no ser posible se recomienda iniciar con el esquema empírico: TDF/FTC + RAL + Etanolato de Darunavir+r, y ajustar después del nacimiento · Realizar estudio de genotipo, sin retrasar el tratamiento** · Evaluar CV en 4 semanas. · En caso de sospecha de resistencia múltiple o interrupciones repetidas al ARV, enviar caso a valoración urgente por el comité asesor correspondiente. (AIII) |
| *Considerar la hospitalización en los casos en que la adherencia se vea comprometida. ** En caso de abandono mayor a 3 semanas y menos de 20 SDG, realizar con presión farmacológica durante 2-4 semanas. CV: carga viral; DTG: dolutegravir; c: cobicistat; EFV: Efavirenz; EVG: elvitegravir; LPV: lopinavir; r: ritonavir; RAL: raltegravir; SDG: semanas de gestación; TDF: tenofovir disoproxil fumarato. | |
4.2. Seguimiento y término del embarazo
El monitoreo integral y periódico desde el momento del diagnóstico en las mujeres con VIH recién diagnosticadas o aquellas con tratamiento previo, permitirá al personal médico tratante analizar las condiciones del término más adecuado del embarazo. El control virológico satisfactorio disminuye considerablemente el riesgo de transmisión perinatal del VIH, sin embargo, debe informarse a las mujeres embarazadas de otros factores asociados a dicha transmisión, tales como: infecciones intrauterinas, ruptura prematura de membranas, etc. (Tabla 44).
Se recomienda realizar por lo menos un recuento de subpoblación de linfocitos CD4 (BIII) y carga viral VIH trimestral para el monitoreo virológico y como apoyo para la planeación de la vía de término del embarazo (AI). De no ser posible, se sugiere realizarlas al momento del diagnóstico y al octavo mes del embarazo.
El tratamiento ARV se debe continuar después de la resolución del embarazo, considerar simplificación o ajuste del TAR posterior a 3 meses del nacimiento en apego a las recomendaciones de pacientes en general y acorde a intención de nuevo embarazo o anticoncepción definitiva.
4.3. Profilaxis intraparto
Por seguridad en las mujeres con VIH, en México NO se recomienda el uso de NVP dosis única o doble dosis antes del parto, debido al riesgo de generar cepas resistentes en las mujeres que viven con VIH y en las y los niños en quienes no se pueda evitar la transmisión del virus.
Tabla 43. Profilaxis intraparto
| Criterios | | Recomendaciones | |
| Paciente en TAR con CV <50 copias/ml |  | NO REQUIERE profilaxis intraparto. Considerar resolución vía vaginal. (BII) Continuar TAR.(BIII) | |
| Si no se cumple el criterio anterior, resolución del embarazo por vía cesárea y profilaxis intraparto | |||
| Paciente en TAR: · Con CV<50 copias/ml y ruptura prematura de membranas · CV>50 copias/ml · CV desconocida |  | Continuar con el tratamiento ARV En caso de sospecha de falla solicitar revaloración del esquema por el comité correspondiente PROFILAXIS PREFERIDO (en caso de disponibilidad de ZDV IV) Iniciar 4 horas antes de la resolución del embarazo: ZDV IV en infusión 2mg/kg durante la primera hora, continuar con infusión 1mg/kg para cada hora hasta el nacimiento, o bien ALTERNATIVO Agregar al esquema habitual ZDV/3TC VO, 1 tableta c/3h, por 3 dosis hasta 1h previa al nacimiento.(AI) | |
| · Sin TAR. · Prueba rápida reactiva en trabajo de parto. | | Iniciar tratamiento ARV con TDF/FTC + RAL o IP/r; más una dosis adicional única de TDF. PROFILAXIS PREFERIDA (en caso de disponibilidad de ZDV IV) Iniciar 4 horas antes de la resolución del embarazo: ZDV IV en infusión 2mg/kg durante la primer hora, continuar con infusión 1mg/kg para cada hora hasta el nacimiento, o bien, agregar al esquema anterior: ZDV/3TC VO, 1 tableta c/3h, por 3 dosis hasta 1h previa al nacimiento.(AI) | |
| ZDV: zidovudina; 3TC: lamivudina; LPV: lopinavir; r: ritonavir; RAL: raltegravir; TDF: tenofovir | |||
En caso de embarazadas con multirresistencia se recomienda valoración por parte de los Comités Institucionales de Resistencia correspondientes, en relación con la profilaxis antirretroviral a administrar a recién nacidas/os. Esta valoración se debe de solicitar DURANTE el embarazo.
4.4. Profilaxis en el recién nacido (RN)
Todos los recién nacidos hijos de madre con infección por VIH, deberán iniciar profilaxis en las primeras 6-12 h de vida hasta un periodo máximo de 72 h. El esquema se establecerá dependiendo de la edad gestacional y de acuerdo a factores de riesgo de transmisión. (Tablas 44, 45 y 46)
Diversos estudios han evidenciado la disminución en las tasas de transmisión materno-fetal y la reducción en la transmisión de cepas resistentes con el uso de terapia combinada en la madre y profilaxis en el recién nacido. (AI)
Existen al momento tres fármacos antirretrovirales aprobados para la profilaxis del recién nacido; Zidovudina (ZDV), Lamivudina (3TC) y Nevirapina (NVP).
Zidovudina es la más conocida y la única con presentación intravenosa, la dosis dependerá del peso y la edad gestacional. (BII) En el caso de prematurez extrema es el único antirretroviral con estudios de seguridad y dosis; este medicamento se recomienda en todos los esquemas profilácticos.
Lamivudina está actualmente recomendada a partir de las 32 semanas de edad gestacional, se administra por 4 semanas y su uso aumenta el riesgo de neutropenia.
Nevirapina se recomienda en los escenarios de mayor riesgo de trasmisión madre-hijo, los estudios para la dosis en los menores de 34 SDG son limitados. En el estudio IMPAACT 1115, el cual todavía se está llevando a cabo, se infiere que la dosis terapéutica de NVP en los neonatos de término es de 6 mg/kg/dosis cada 12 horas, con lo cual se logran concentraciones séricas > 3 mg/l.
En RN > 37 semanas de edad gestacional y de alto riesgo, recomendamos la combinación de ZDV+3TC+NVP (la ZDV y 3TC por 4 semanas y la NVP por 2 semanas) Vía oral. Existe muy escasa información en recién nacidos utilizando profilaxis triple a dosis completa principalmente con nevirapina, pero dado el elevado riesgo de transmisión perinatal del VIH en estas circunstancias y los probables beneficios esperables (probable modulación y establecimiento del reservorio en niños con VIH), el grupo de niños recomienda su utilización, explicando previamente a los padres del menor esta situación, principalmente la seguridad y toxicidad. (BII)
Algunas guías internacionales recomiendan administrar a los recién nacidos mayores de 34 semanas de gestación y de alto riesgo la combinación de zidovudina con lamivudina durante 4 semanas + nevirapina únicamente 3 dosis (al nacimiento, día 2 y día 6 de vida) por la vida media de este medicamento en el recién nacido de término.
En RN de alto riesgo de infección por VIH, aunque no es lo óptimo, en situación remota que únicamente tengan disponible la zidovudina, se recomienda administrarla por seis semanas, aunque no administren la NVP y/o lamivudina.
Es recomendable que, para administrar antirretrovirales por vía oral al RN, exista tolerancia adecuada a la vía oral (leche) y sin afección abdominal.
En caso de embarazadas con multirresistencia se recomienda valoración por los Comités Institucionales de Resistencia correspondientes, en relación con la profilaxis ARV a administrar al recién nacido. Esta valoración se debe de solicitar DURANTE el embarazo.
En los casos de confirmación de la infección por VIH en un neonato se deberá iniciar el tratamiento antirretroviral inmediatamente, suspendiendo las dosis usadas en la profilaxis y cambiando a las dosis terapéuticas según la edad gestacional y el peso del recién nacido.
Tabla 44. Nivel del riesgo de trasmisión del VIH en recién nacidos expuestos al virus
| Riesgo de exposición al VIH | |
| RN expuesto al VIH, bajo riesgo (cumplir con todos los enunciados) | RN expuestos al VIH, alto riesgo (al menos uno de los enunciados) |
| · Supresión viral cerca del parto (alrededor de la semana 36) · TARV durante el embarazo y parto · Sin problemas de apego al TARV | · CV detectable o se desconoce cerca al parto · Madre sin TARV en el embarazo y en el parto · Diagnóstico y tratamiento en la madre después de las 28 semanas de embarazo · Diagnóstico en la madre durante el parto o posparto · RN con prueba de anticuerpos-VIH positiva, en el cual se desconoce el estatus de la madre · Madre con enfermedad avanzada · Factores obstétricos: ruptura de membranas mayor a 4 horas y/o ITS concomitante y/o hemorragia durante el parto/cesárea · Síndrome retroviral agudo durante el embarazo o la lactancia · Parto vaginal en madre con factor de riesgo |
Tabla 45. Tipo de esquema antirretroviral de acuerdo al nivel del riesgo de transmisión al VIH en
recién nacidas y nacidos expuestos al virus
recién nacidas y nacidos expuestos al virus
| Riesgo de transmisión de VIH del recién nacido | Profilaxis ARV para RN > 34 SDG * | Duración |
| Bajo | ZDV | 4 semanas |
| Alto | ZDV + 3TC + NVP | ZDV+3TC durante 4 semanas |
| NVP dosis profiláctica durante 2 semanas | ||
| ZDV + NVP | ZDV durante 4 semanas | |
| NVP 3 dosis | ||
| Se confirma infección por VIH en el RN | Tratamiento ARV ZDV + 3TC + NVP | Consultar tablas 31 y 32 |
| *<34 semanas de gestación ajustar el esquema con los ARV aprobados con base a peso y edad gestacional | ||
Tabla 46. Profilaxis antirretroviral en recién nacidas y nacidos expuestos al VIH
| ARV | Dosificación | Duración de ARV | ||
| Zidovudina solución 10mg/ml | >35 SDG | · 4 mg/kg/do VO c/12 h · Si no tolera la vía oral: 3 mg/kg/dosis IV c/12 h Dosis simplificada por rango de peso, para RN a término | Del nacimiento a 4 semanas | |
| Rango de peso (kg) | Dosis (ml) cada 12 h de ZDV solución 10mg/ml | |||
| 2 a < 3 kg | 1 ml | |||
| 3 a < 4 kg | 1.5 ml | |||
| 4 a < 5 kg | 2 ml | |||
| >30 y <35 SDG | 2 mg/kg/do VO c/12 h o 1.5 mg/kg/do IV c/12 h A partir de los 15 días de vida incrementar a: 3 mg/kg/dosis IV c/12 o 2.3 mg/kg/dosis IV c/12 h | |
| < 30 SDG | 2 mg/kg/do VO c/12 h o 1.5 mg/kg/do IV cada 12 h | |
| Lamivudina solución 10 mg/ml | > 32 SDG | Del nacimiento a la 4ª semana: 2 mg/kg/dosis VO c/12 h Dosis simplificada por rango de peso, > 35 SDG | Del nacimiento a 4 semanas | |
| Rango de peso (kg) | Dosis (ml) cada 12 h 3TC solución 10 mg/mL | |||
| 2 a < 3 kg | 0.6 ml | |||
| 3 a < 4 kg | 0.8 ml | |||
| 4 a < 5 kg | 1 ml | |||
| Nevirapina suspensión 10mg/ml | Opción 1 (>34 SDG): · 1° semana: 2 mg/kg/dosis VO c/24 h · 2° semana: 4 mg/kg/dosis VO c/24 h | 2 semanas | ||
| Opción 2: · 1° dosis: de preferencia en las primeras 48 h de vida · 2° dosis: a las 48 horas de la 1° dosis · 3° dosis: a las 96 horas de la 2° dosis Peso al nacimiento de 1.5 a 2 kg: 8 mg VO Peso al nacimiento >2 kg: 12 mg VO | 3 dosis en los primeros 7 días | |||
4.5. Diagnóstico del menor de 18 meses expuesto al VIH
El diagnóstico de infección por VIH en el hijo de madre infectada, deberá ser lo más pronto posible para iniciar un tratamiento inmediato.
En los menores de 18 meses el diagnóstico de la infección por VIH se realiza por pruebas virológicas ya que los anticuerpos transferidos por la madre pueden permanecer de 12-18 meses, dando pruebas serológicas falsas positivas, por lo que las pruebas como ELISA están recomendadas en los lactantes mayores de 18 meses. (AII)
En este grupo de edad (<18 meses) se puede diagnosticar la infección por el VIH por PCR de ADN viral o PCR de ARN viral (carga viral-VIH). La sensibilidad del PCR-ADN al nacimiento es del 55% y de la prueba de PCR- ARN es del 25 al 58% en las primeras semanas de vida. La sensibilidad de ambas pruebas aumenta con la edad, de tal manera que cercano a los 3 meses de edad se diagnostica del 90 al 100% de los casos. (AII)
Se recomienda realizar la primera prueba virológica al nacimiento o lo más cercano al mismo y que la muestra de sangre no sea obtenida del cordón umbilical. En la situación de que exista el antecedente de que el recién nacido recibió seno materno se recomienda realizar 2 pruebas virológicas, a las 2 y 6 semanas de haberlo suspendido. (AII)
4.5.1. Criterios laboratoriales y clínicos para establecer el diagnóstico de VIH
En niños menores de 18 meses de edad, sin antecedentes de haber recibido lactancia materna, se establece o se descarta el diagnóstico de infección por el VIH con los parámetros descritos en el algoritmo 3.
En la tabla 47 se describen los criterios para el diagnóstico de infección/no infección por el VIH.
Tabla 47. Criterios de infección por VIH en niñas y niños expuestos vía materna, <18 meses de edad
| Criterios | Comentarios |
| Infectado | 2 pruebas virológicas positivas (detectables) en muestras sanguíneas diferentes*. (AI) |
| NO infectado, en niño o niña NO amamantado | Al menos 2 pruebas virológicas negativas (indetectables), una > 1 mes de edad y otra > 4 meses de edad y sin datos clínicos/laboratoriales que sugieran infección por el VIH. (AI) |
| NO infectado, en niño o niña amamantado | 3 pruebas virológicas negativas (indetectables) después de 4-6 semanas, 3 y 6 meses de haberse suspendido el seno materno y estar clínica y laboratorialmente sano. (AII) |
| Confirmación de NO infección | ELISA-VIH a los 18 meses no reactivo (negativo). Se confirma serorreversión**. (AII) |
| *Cuando se tiene una prueba virológica positiva (detectable) realizar otra determinación lo más pronto posible. **En caso de ELISA reactivo a los 18 meses, se aconseja solicitar interconsulta a centro de atención especializado | |
Algoritmo 3. Flujograma de diagnóstico en el recién nacido
4.5.2. Seguimiento del niño y niña expuesto al VIH
Cuando se confirme que el niño no está infectado con el VIH, se recomienda el seguimiento clínico cada año o antes si se considera necesario, para vigilancia de toxicidad mitocondrial y eventos adversos por el antecedente de haber estado expuesto al VIH in útero y/o haber recibido antirretrovirales en algunos casos. (AII) Además se sugiere canalizarlo al primer nivel de atención para incorporarlo al programa del control de niño sano. (BIII)
Tabla 48. Seguimiento del recién nacido y lactante expuesto al VIH vía materna
| | 0 a 48 h | 2 sem | 4 sem | 68 sem | 4 meses | 6 meses | 18 meses | |
| Actividades | Carga Viral | X | Xa | | Xb | X | | |
| Linfocitos CD4+ | Xc | | | | | | | |
| Verificar dosis de profilaxis | Xd | X | X | | | | | |
| BH | X | X | | Xe | | | | |
| Serología VHB, VHC y VDRL | Xf | | | | | | | |
| Profilaxis P. jirovecii | | | | Xg | | | | |
| ELISA-VIH | | | | | | | X | |
| Crecimiento y desarrollo | X | X | X | X | X | X | X | |
| Vigilancia de vacunación | X | X | X | X | X | X | X | |
| a En caso de alta sospecha de infección por VIH en RN realizar además una prueba de CV a las 2-4 semanas de vida. b Si el niño/a recibió profilaxis ARV la determinación de CV se realizará a las 2 semanas de suspender la profilaxis. c Junto con la 1° determinación de CV, independientemente de la edad; si los CD4+ están alterados se recomienda repetirlos. d 48 a 72 horas de vida y cada vez que se tenga contacto con el personal de salud. e Al suspender la profilaxis antirretroviral. f En caso de no contar con el resultado materno por escrito gMantener hasta descartar infección por VIH | ||||||||
En la tabla 48 se describen las actividades (clínicas y laboratoriales) que se recomiendan realizar en los RN y lactantes expuestos al VIH (NO INFECTADOS) y en las tablas 3 y 4s, e describe actividades clínicas y laboratoriales a realizarse durante el seguimiento de niños y niñas con VIH.
4.6. Lactancia
Para las y los hijos de las mujeres con VIH, la lactancia materna representa una importante fuente de transmisión del virus. Las tasas estimadas de transmisión de la madre al hijo varían entre el 14 y el 25 % en Europa y América y entre el 13 y el 42 % en países en vías de desarrollo, existe un riesgo adicional por lactancia materna del 5-20%. Los factores que facilitan la transmisión del virus durante la lactancia son:
· Carga viral materna alta plasmática y en leche materna
· Mastitis y abscesos
· Candidiasis oral en el lactante
· Enfermedad clínica-inmunológica avanzada en la madre
· Lactancia mixta (AI)
· Infección aguda en la madre
· Período prolongado de lactancia más allá de seis meses
4.6.1. Recomendaciones para la lactancia materna en mujeres con VIH:
Si bien existen datos obtenidos de estudios realizados en África que han demostrado que los ARV puede reducir significativamente el riesgo de transmisión vertical del VIH por lactancia materna. Estas prácticas aplican únicamente en entornos en los que la alimentación con fórmula no garantiza los criterios de AFASS (aceptabilidad, factibilidad, asequibilidad, sostenible y segura), y donde la mortalidad de alimentación con fórmula supera el riesgo de transmisión del VIH. Aunque el riesgo de transmisión por lactancia se reduce por el uso de ARV en la madre, el riesgo no se elimina por completo, por lo que la supresión de la lactancia materna es la única medida 100% segura de evitar la transmisión por esta vía en el lactante.
Por lo anterior TODOS los hijos de mujeres que viven con VIH, independientemente de la profilaxis que recibieron y tipo de esquema ARV materno, deben ser alimentados con fórmula (AI), garantizando los criterios de AFASS.
Por lo que las instituciones deben garantizar la provisión de fórmula láctea desde el postparto inmediato y al menos durante los primeros seis meses de vida, así como consejería especializada sobre la alimentación del recién nacido.
Evitar lactancia mixta (administración de lactancia materna y fórmula láctea). Es importante informarle a la madre los riesgos y beneficios de no administrar lactancia materna. (AII)
En caso de sospecha de infección en la madre, se recomienda no administrar lactancia materna hasta contar con los resultados de laboratorio que descarten o confirmen el diagnóstico, lo cual debe de hacerse lo más rápido posible; al momento que se descarte la infección por el VIH en la madre, iniciar la administración de lactancia materna al recién nacido.
En el momento actual, la única estrategia 100% eficaz para evitar la transmisión de VIH por lactancia materna, es la sustitución de la lactancia materna por la alimentación con fórmula láctea. Si una mujer es diagnosticada con infección por el VIH, durante o después de la lactancia, se deberá descartar la infección en la niña o niño sin demora.
Se recomienda evitar la premasticación (cuando la persona al cuidado del menor es VIH-positiva, mastica los alimentos y los introduce en la boca del menor) debido a que se ha asociado con casos de transmisión del virus por esta vía. (AII)
4.7. Consejería y uso de métodos anticonceptivos en mujeres con VIH en edad reproductiva
La anticoncepción es una intervención basada en múltiples visitas con el personal de salud, tiene la intención de identificar factores de riesgo asociados a eventos adversos maternos y fetales, proveer educación y brindarle instrumentos a cada paciente con base en sus necesidades e inquietudes personales.
En la población de mujeres que viven con VIH, la anticoncepción es un componente esencial en la atención y debe incluirse la consejería respecto de la efectividad y adecuación de cada método anticonceptivo. El objetivo primordial es reducir la posibilidad de embarazos no planeados.
La consejería sobre anticoncepción debe puntualizar datos como prácticas sexuales seguras, eliminar el alcohol, el uso de drogas ilícitas y el tabaquismo. Para las mujeres que contemplan embarazarse y están recibiendo TAR, se debe considerar la administración de esquemas ARV que NO contengan elvitegravir/cobicistat, dolutegravir o medicamentos con potencial teratogénico (AIII). Para más información sobre consejería para mujeres con VIH se recomienda consultar la Guía de Salud Sexual y Reproductiva para Mujeres y VIH del Centro Nacional de Equidad y Género y Salud Reproductiva.
4.8. Monitoreo de pacientes embarazadas serodiscordantes (VIH-negativas con pareja que vive con el VIH)
Todas las mujeres VIH-negativas con pareja serodiscordante, deben recibir información y consejería del beneficio del monitoreo de su estado serológico y el beneficio de la profilaxis antirretroviral en situaciones en las cuales decida embarazarse.
Se le debe informar a la mujer (como a todas las pacientes embarazadas) la necesidad de llevar a cabo una prueba de detección para el VIH en el momento que acude para valoración. Además, se le debe realizar una segunda prueba para VIH durante el tercer trimestre, de preferencia antes de la semana 36 de gestación. Si se presenta en trabajo de parto sin haber tenido una prueba de VIH en el tercer trimestre, se le debe realizar prueba rápida de detección en el área de labor.
Ante la dificultad de excluir un diagnóstico positivo en una mujer embarazada con una pareja que vive con VIH, y teniendo en cuenta el riesgo permanente de infección, se recomienda que todas las mujeres embarazadas bajo este escenario y con la evaluación previa apropiada, reciban tratamiento antirretroviral, durante el embarazo a fin de prevenir la posible transmisión vertical del virus. En suma, es prioritario reforzar las acciones de prevención como es el uso consistente y adecuado del condón.
Si durante algún momento del embarazo, el médico o médica sospecha que la paciente se encuentra en periodo de seroconversión (ej. presenta signos y síntomas de síndrome retroviral agudo) está indicado realizar la determinación de carga viral ARN-VIH y prueba de anticuerpos, las cuales se repetirán después de 4 a 6 semanas. Si el resultado convencional o la prueba rápida para VIH son positivos, las mujeres deben recibir la
evaluación apropiada y las intervenciones enunciadas en este documento con la finalidad de disminuir la transmisión perinatal del VIH.
Aún en caso de que las pruebas confirmatorias no estén disponibles, se debe implementar la estrategia para reducir la transmisión perinatal sin esperar el resultado. Si las pruebas de VIH son negativas, se debe llevar a cabo consejería especializada de forma regular y junto con la pareja con respecto al riesgo de transmisión del VIH. En todos los casos, las parejas deben ser informadas sobre el uso consistente y adecuado del preservativo. Para más información sobre consejería para mujeres serodiscordantes se recomienda consultar la Guía de Salud Sexual y Reproductiva para Mujeres y VIH del Centro Nacional de Equidad y Género y Salud Reproductiva.
Tabla 49. Recomendaciones sobre el uso de anticonceptivos en mujeres que estén recibiendo terapia
ARV (si existe riesgo de ITS, incluido riesgo durante el embarazo o post-parto, se recomienda el uso
correcto y sistemático de preservativo, bien por sí solos o junto con otro método anticonceptivo)
ARV (si existe riesgo de ITS, incluido riesgo durante el embarazo o post-parto, se recomienda el uso
correcto y sistemático de preservativo, bien por sí solos o junto con otro método anticonceptivo)
| ARV | Categoría I=inicio del uso, C=continuación del uso | Aclaraciones | ||||||||
| ACO | P/A | ACI | AGO | DMPA | NET-EN | LNG/ETG | DIU-LNG | |||
| INTR | I | C | aNo existen interacciones conocidas entre la terapia antiretroviral y el uso de DIU. Sin embargo, la situación de enfermedad clínica por VIH grave o avanzada está clasificada como categoría 3 para el inicio del uso y categoría 2 para la continuación del uso. La enfermedad clínica por VIH asintomática o leve está clasificada como categoría 2 tanto para el inicio como para la continuación bLos antiretrovirales pueden disminuir o aumentar los niveles de hormonas esteroideas en las usuarias de anticonceptivos hormonales. Los datos farmacocinéticos sugieren posibles interacciones farmacológicas entre ciertos antiretrovirales (en particular, algunos INNTR e inhibidores de la proteasa reforzados con ritonavir) y algunos anticonceptivos hormonales. Dichas interacciones pueden reducir la eficacia del anticonceptivo hormonal. | |||||||
| ABC | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 2/3a | 2a | |
| TDF | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 2/3a | 2a | |
| ZDV | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 2/3a | 2a | |
| 3TC | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 2/3a | 2a | |
| FTC | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 2/3a | 2a | |
| INNTR | I | C | ||||||||
| EFV | 2b | 2b | 2b | 2b | 1 | 2b | 2b | 2/3a | 2a | |
| ETV | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 2/3a | 2a | |
| NVP | 2b | 2b | 2b | 2b | 1 | 2b | 2b | 2/3a | 2a | |
| RPV | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 2/3a | 2a | |
| Inhibidores de la proteasa | I | C | ||||||||
| ATV/r | 2b | 2b | 2b | 2b | 1 | 2b | 2b | 2/3a | 2a | |
| LPV/r | 2b | 2b | 2b | 2b | 1 | 2b | 2b | 2/3a | 2a | |
| Darunavir o Etalonato de Darunavir /r | 2b | 2b | 2b | 2b | 1 | 2b | 2b | 2/3a | 2a | |
| RTV | 2b | 2b | 2b | 2b | 1 | 2b | 2b | 2/3a | 2a | |
| Inhibidores de la integrasa | I | C | ||||||||
| RAL | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 2/3a | 2a | |
| EVG/c | 2b | 2b | 2b | 2b | 2b | 2b | 2b | 2/3a | 2a | |
| DTG | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 2/3a | 2a | |
| Categoría 1: situación para la que no existen restricciones al uso del método anticonceptivo; categoría 2: situación en la que, en general, las ventajas de utilizar el método superan a los riesgos teóricos o demostrados; categoría 3: Situación en la que, en general, los riesgos teóricos o demostrados superan a las ventajas de utilizar el método; categoría 4: situación en la que el uso del método anticonceptivo en cuestión representa un riesgo inaceptable para la salud. A: anillo vaginal anticonceptivo combinado; ACI: anticonceptivos combinados inyectables; ACO: anticonceptivos combinados orales; AGO: anticonceptivo con gestágenos oral; CME: Criterios médicos de elegibilidad para el uso de anticonceptivos (publicación de la OMS); DIU: dispositivo intrauterino; DIU-LNG: DIU liberador de levonogestrel (20 µg/24 horas); DMPA: acetato de medroxiprogesterona de depósito; DTG: Dolutegravir ITS: Infección de transmisión sexual; LNG/ETG: implantes de levonogestrel y de etonogestrel; NET-EN: enantato de noretisterona; P:parche anticonceptivo combinado; ABC: abacavir;TDF:tenofovir;ZDV:zidovudina;3TC:lamivudina;DDI:didanosina;FTC:emtricitabina; D4T:estavudina; EFV: efavirenz; ETV: etravirina; NVP: nevirapina; RPV: Rilpivirina; ATV: atazanavir; r: reforzado con ritonavir; LPV: lopinavir; RTV: ritonavir; RAL: raltegravir. Adaptación de: Anexo 1 de Métodos anticonceptivos hormonales para mujeres con VIH o alto riesgo de VIH Informe de orientación. OMS, 2014. | ||||||||||
Anexo I. Comorbilidades en la infección por VIH
Las comorbilidades se refieren a las enfermedades cardiovasculares ateroesclerosas prematuras, renales, hepáticas, metabólicas, neoplásicas y óseas, así como a las alteraciones neurocognitivas y la disfunción sexual.
Tabla I-A. Modificaciones en el estilo de vida (como intervención general) recomendadas en personas
que viven con VIH
que viven con VIH
| Abandono del tabaco | a. Consejo sobre la necesidad de dejar de fumar. b. Si la persona no lo contempla, enfatizar los aspectos positivos a corto plazo (menos gastos, mejor piel, mejor sabor de la comida, menos disnea) y beneficios a largo plazo (prevención de EPOC, enfermedades cardio y cerebrovasculares, cáncer de pulmón). c. Si la persona lo contempla, intentar fijar una fecha, establecer un sistema de refuerzo. d. Si es necesario, utilizar sustitución con nicotina (parches, chicles, aerosoles), vareniclina o bupropión durante la fase de destete. Nota: ambos fármacos pueden causar reacciones adversas sobre el sistema nervioso central, incluido suicidio; el bupropión puede interaccionar con IP y NN. e. Considerar remitir a la persona con especialista para dejar de fumar. f. Anticipar recaídas, explicar y considerarlas como parte del proceso hasta la abstinencia final de nicotina. |
| Consejo dietético | a. Las intervenciones dietéticas no deben interferir con las necesidades dietéticas necesarias para una adecuada absorción del TAR. b. Mantener la ingesta calórica equilibrada con el gasto energético. c. Limitar la ingesta de grasas saturadas, colesterol y azúcares refinados. d. Reducir la ingesta total de grasa a < 30% y colesterol a < 300 mg/día. e. Aconsejar el consumo de verduras, frutas y productos integrales ricos en fibra. f. Reducir las bebidas y comidas con azúcar añadido. g. Elegir y preparar comidas con poca o nada de sal. Tratar de tomar menos de 1,500 mg de sodio al día. h. Aconsejar el consumo de pescado, pollo (sin piel) y carne magra. i. Considerar referir a nutriología, realizar un diario dietético durante una semana, para revelar las calorías «ocultas». j. Evitar las comidas compulsivas. k. En personas con síndrome de desgaste relacionado con el VIH y dislipidemia, tratar el desgaste en primer lugar y referir a nutriología. l. A las personas con sobrepeso se les debe aconsejar que adelgacen. No son recomendables dietas muy hipocalóricas (disminuyen potencialmente los mecanismos de defensa inmunitaria). IMC normal: 18.5 a 24.9kg/m2; sobrepeso: 25 a 29.9kg/m2; obesidad >30 kg/m2. Trátese la desnutrición. |
| Disminución del consumo de alcohol | Las siguientes preguntas son útiles para determinar el consumo promedio de alcohol: 1. ¿Qué tan frecuentemente toma alcohol?: nunca, una vez por mes o menos, 2 a 4 por mes, 2 a 3 por semana, más de 4 por semana 2. Si toma alcohol, ¿qué es lo típico en una sesión?: 1 a 2, 3 a 4, 5 a 6, 7 a 9, 10 o más copas. 3. ¿Qué tan frecuente toma 6 o más copas en una sesión?: nunca, menos de una vez al mes, una vez al mes, una vez a la semana, casi diario. a. El consumo de alcohol se debe restringir a no más de una copa al día en mujeres y dos al día para hombres (< 20-40 g/dl). b. Debe motivarse el abandono o la reducción importante del consumo de alcohol en personas con insuficiencia hepática, problemas de adherencia al tratamiento, un aumento inadecuado de linfocitos CD4, tumores, tuberculosis pasada, diarrea y otras enfermedades asociadas con un elevado consumo de alcohol. |
| Promoción del ejercicio | Promover un estilo de vida activo para prevenir y tratar la obesidad, la hipertensión y la diabetes. Aconsejar actividad física moderada (subir escaleras, ir al trabajo en bicicleta o caminando, ciclismo, natación, excursionismo, etc.) Recomendar ejercicio físico regular moderado, no intenso. Realizar ejercicio cardiovascular (ej. caminar deprisa durante 30 minutos > 5 días por semana). Mantener la fuerza muscular y la flexibilidad de articulaciones. |
*FUENTE: Adaptada de EACS (European AIDS Clinical Society Guidelines 7.02), 2014.
La incidencia de estas comorbilidades va en incremento en las personas que viven con VIH como consecuencia, por una parte, por la mayor expectativa de vida, y por la otra, por efecto de los estados de inmunodeficiencia residual, de activación inmune e inflamación crónicas, de las alteraciones de la coagulación y de las coinfecciones (tales como el virus de la hepatitis C y el citomegalovirus) que persisten durante años a pesar del control en la replicación del VIH, así como por efectos adversos de los antirretrovirales. En esta sección se abordan los principios en la prevención y el manejo de las dislipidemias y de las alteraciones en el metabolismo de la glucosa.
Dislipidemias
El abordaje de la dislipidemia deberá de ser «en paquete», atendiendo y corrigiendo siempre los otros factores de riesgo de enfermedad cardiovascular como: hipertensión arterial, hipercoagulabilidad, trastorno metabólico de la glucosa, tabaquismo, sedentarismo, sobrepeso/obesidad. Consulte la sección de cambio del esquema antirretroviral, cuando hay control viral, como medida de prevención o corrección de las dislipidemias.
Tabla I-B. Efecto diferencial sobre lípidos séricos de diversos antirretrovirales
| Clase de ARV | Fármaco ARV | Efecto | |||
| Colesterol total | Triglicéridos | HDL-C | LDL-C | ||
| INNTR | Nevirapina (NVP) | | | | |
| Efavirenz (EFV) | | | | | |
| Etravirina (ETV) | | | | Sin cambio | |
| Rilpivirina (RPV) | Sin cambio | Sin cambio | Sin cambio | Sin cambio | |
| INTR | Estavudina (d4T)** | | | | |
| Zidovudina (ZDV) | | | | Sin cambio | |
| Lamivudina (LAM o 3TC) | | | | Sin cambio | |
| Abacavir (ABC) | Sin cambio | Sin cambio | | Sin cambio | |
| Abacavir/lamivudina (ABC/LAM) | | | | Sin cambio | |
| Abacavir/lamivudina/zidovudina (ABC/LAM/ZDV) | | | | Sin cambio | |
| Didanosina (DDI) | Sin cambio | | | Sin cambio | |
| Emtricitabina (FTC) | | | | Sin cambio | |
| Tenofovir (TDF) | Sin cambio | Sin cambio | Sin cambio | Sin cambio | |
| Emtricitabina/tenofovir (FTC/TDF) | /Sin cambio | /Sin cambio | /Sin cambio | Sin cambio | |
| Inhibidor de Integrasa | Raltegravir (RAL) | Sin cambio | Sin cambio | Sin cambio | Sin cambio |
| Inhibidores de Proteasa* | Indinavir (IDV)** | | | Sin cambio | |
| Saquinavir (SQV) | | | | | |
| Lopinavir/ritonavir (LPV/r) | | / | Sin cambio | | |
| Fosamprenavir (FPV) | | / | Sin cambio | | |
| Atazanavir (ATV) | Sin cambio | Sin cambio | Sin cambio | Sin cambio | |
| Darunavir ó Etalonato de Darunavir | | | Sin cambio | | |
| Inhibidor de Fusión/ Entrada | Enfuvirtida (T-20) | Sin cambio | Sin cambio | Sin cambio | Sin cambio |
| Maraviroc (MVC) | Sin cambio | Sin cambio | Sin cambio | Sin cambio | |
| *Todos los IP se refuerzan con ritonavir (su efecto ya considerado). ** Medicamentos actualmente en desuso por su alta toxicidad o falta de potencia. Fuente: Adaptado de Martin A and Emery S. Exp. Rev. Clin Pharmacol 2009;2:381389 | |||||
Tabla I-C. Clasificación de las personas con VIH de acuerdo con la concentración sérica de las
lipoproteínas
lipoproteínas
| Lipoproteína | Con concentración óptima (mg/dl) | Con concentración limítrofe(mg/dl) | Con concentración que incrementa el riesgo de enfermedad cardiovascular (mg/ dl) |
| CT | <200 | 200 a 239 | >240 |
| HDL-C | >60 | 40 a 59 hombres 50 a 59 mujeres | <40 hombres <50 mujeres |
| LDL-C | <100 óptimo(100-129 cerca al óptimo) | 130 a 159 | 160-189 alto >190 muy alto |
| TG* | <150 | 150 a 199 | 200-499 alto >500 muy alto |
| CT: Colesterol total; HDL-C: Colesterol de alta densidad; LDL: Colesterol de baja densidad; TG: Triglicéridos; *TG >1000 indica riesgo alto para pancreatitis. Fuente: AACE Lipid Guideline. Nedcor Pact 2012; 18 (Supple 1): S1-S78. | |||
Tabla I-D. Manejo del colesterol LDL de acuerdo con el riesgo estimado de enfermedad arterial
coronaria a 10 años
coronaria a 10 años
| Riesgo a 10 años2 | Meta terapéutica de la concentración sérica del C-LDL | Nivel de C-LDL para iniciar intervenciones el estilo de vida | Nivel de C-LDL para considerar terapia farmacológica hipolipemiante |
| Más de 20% | <100 mg/dl | >100 mg/dl | Si hay enfermedad coronaria o equivalente4 |
| De 10 a 20 % | <130 mg/dl | >130 mg/dl | >130 |
| Menor al 10%: con 2 o más factores de riesgo3 | <130 mg/dl | >130 mg/dl | >160 |
| Menor al 10%: con ningún o solo un factor de riesgo | <160 mg/dl | >160 mg/dl | >190 (160 a 189 fármaco opcional) |
| 1 ATP III. Circulation 2002; 106:3143 2 De acuerdo a la escala de Framingham 3Edad (hombre > 45 años y mujer > 55 años); historia familiar de enfermedad cardiovascular prematura (muerte súbita antes de los 55 años en padre o familiar hombre de primer grado y antes de 65 años en madre o familiar mujer de primer grado); tabaquismo actual; hipertensión arterial (> 140/90 mm de Hg o en terapia antihipertensiva); C-HDL < 40 mg/dl 4Diabetes y manifestaciones clínicas de formas no coronarias de enfermedad ateroesclerosa (enfermedad arterial periférica, aneurisma de la aorta abdominal y enfermedad arterial carotidea). NOTA. Meta de TG: menor a 150 mg/dl y nivel para considerar terapia hipolipemiante: más de 500 mg/dl; esto aplica para todos los pacientes independientemente del riesgo de ECV. |
Tabla I-E: Efecto en lípidos séricos de diversos hipolipemiantes
| Hipolipemiante | Colesterol LDL | Colesterol HDL | Triglicéridos |
| Secuestradores de ácidos biliares | 15 a 25% | Sin cambios | Sin cambios |
| Niacina (ácido nicotínico) | 10 a 25% | 10 a 35% | 20 a 30% |
| Inhibidores de HMG CoA reductasa (estatinas) | 21 a 55% | 2 a 10% | 6 a 30% |
| Fibratos (gemfibrozil y fenofibrato) | 20 a 25% | 6 a 18% * | 20 a 35% |
| Inhibidor de la absorción del colesterol (ezetimiba) | 10 a 18% | | sin cambio |
| Ác. 3 omega | 4 a 49% | 5 a 9% | 23 a 45% |
| Fuente: AACE lipid and atherosclerosis guidelines, Endocr Pract 2012; 18 (suppl 1):16-17 | |||
Tabla I-F: Tratamiento hipolipemiante con estatinas e inhibidores de la absorción del colesterol
| Familia de fármacos | Fármaco | Dosis | Reducción en C-LDL | Reducción en TG | Efectos secundarios | Ajuste de dosis de acuerdo con el tipo de antirretrovirales | |
| con IP/r | con INNTR | ||||||
| Estatina | Atorvastatina | 10-80 mgc/24 h | 38 a 54% | 14 a 33% | Síntomas gastrointestinales, cefalea, insomnio, miopatía, rabdomiolisis (rara) y hepatitis tóxica | Iniciar con dosis bajas (máx:40 mg) | Considerar dosis más altas |
| Fluvastatina | 20-80 mgc/24 h | 17 a 33% | Mínima | Considerar dosis más altas | Considerar dosis más altas | ||
| Pravastatina | 20-80 mgc/24 h | 19 a 40% | Mínima | Considerar dosis más altas | Considerar dosis más altas | ||
| Rosuvastatina | 5-40 mgc/24 h | 52 a 63% | 14 a 33% | Iniciar con dosis bajas (máx:20 mg) | Iniciar con dosis bajas | ||
| Simvastatina | 10-40 mgc/24 h | 28 a 41% | Mínima | Contraindicada | Considerar dosis más altas | ||
| Inhibidores de la absorción del colesterol** | Ezetimiba (En caso de falta de respuesta con estatinas para el control de LDL) | 10 mg/día | 17% | | Síntomas gastrointestinales | No se conocen interacciones farmacológicas con TAR | |
| *No tiene actividad en TG Fuentes: EACS 2014 y UpToDate 2014 (Statins: actions, side effects and administration) | |||||||
Trastornos en el metabolismo de la glucosa
Tabla I-G: Criterios diagnósticos de los trastornos en el metabolismo de la glucosa
| Diagnóstico Trastorno de la glucosa | Glucemia en ayuno (mg/dl) | Valor de Tolerancia a la Glucosa con Carga de 75 g a 2 horas (mg/dl) | HbA1c |
| Diabetes* | >126 ** | >200 | >6.5% |
| Intolerancia a la glucosa | - | 140 a 199 | Prediabetes 5.7 a 6.4% |
| Glucemia en ayuno alterada | 100 a 125 | - | |
| *o glucemia en cualquier momento = 200 mg/dl acompañada de poliuria y polidipsia **Deberá ser confirmada, mediante repetición de la prueba. Fuente: ADA Clinical Practice Recommendation 2014 | |||
Tabla I-H. Modificaciones en el estilo de vida en pacientes con diabetes
| Tratamiento nutricional |
| Se recomienda la reducción de ingesta calórica para promover la pérdida de peso. A Monitorear la ingesta de carbohidratos (CH), sigue siendo una estrategia clave para alcanzar el control glucémico. B Preferir la ingesta de CH de las verduras, frutas, granos enteros, legumbres y productos lácteos sobre otras fuentes, especialmente los que contienen grasas, azúcares o sodio. B Consumo reducido de alimentos que contienen sacarosa (azúcar de mesa). A Consumir fibra en la dieta (14 g de fibra/1.000 kcal) y alimentos con granos integrales Evitar el consumo de bebidas endulzadas con azúcar para reducir el riesgo de aumento de peso y empeoramiento del perfil de riesgo cardiometabólico. B La dieta rica en ácidos grasos monoinsaturados, como aceite de oliva, aguacate, frutos secos, almendras, ternera y productos lácteos, puede beneficiar el control glucémico y los factores de riesgo de ECV. B Recomiende un aumento en los alimentos que contienen ácidos grasos de cadena larga (EPA y DHA) y n-3 ácido linolénico (ALA), como soya, nuez, cacahuate, pescado y aceites de pescado; debido a sus efectos beneficiosos sobre las lipoproteínas, la prevención EAC. B Reducir la ingesta de sodio a <2,300 mg/día. B No se recomienda la suplementación de rutina con antioxidantes, como las vitaminas E, C y caroteno, debido a la falta de pruebas de eficacia. A |
| Actividad física |
| Realizar al menos 150 min/semana de actividad física aeróbica de intensidad moderada (50-70% de la frecuencia cardíaca máxima), repartidas en al menos 3 días de la semana con no más de 2 días consecutivos sin ejercicio. A En ausencia de contraindicaciones, estas personas deben ser animadas a realizar entrenamiento de la resistencia por lo menos 2 veces por semana. A Pérdida de peso moderada (7% del peso corporal), IMC ideal 18.5 24.9 kg/m2A |
Tabla I-I. Tratamiento hipoglucemiante
***En materia de prevención de enfermedad cardiovascular hay muy pocos datos sobre hipoglucemiantes orales y ningún dato en personas que viven con el VIH. Actualmente se están evaluando las incretinas; inhibidores de DDP4 (p. ej. saxagliptina, sitagliptina) y los agonistas de GLP-1 (p. ej. liraglutida y exenatida) en varios estudios importantes de morbilidad y mortalidad; no se esperan interacciones farmacológicas clínicamente importantes o reacciones adversas sobre el número de células CD4; se cuestiona el uso clínico de pioglitazona por sus reacciones adversas; en ancianos con diabetes de tipo 2 de larga duración.
Fuente: Adaptado de: European AIDS Clinical Society Guidelines 7.02, 2014.
Tabla I-J. Efecto de diversos antirretrovirales en el metabolismo de la glucosa
| Clase | Medicamento | Tipo de efecto |
| INNTR | Nevirapina (NVP) | /sin efecto |
| Efavirenz (EFV) | | |
| Etravirina (ETV) | | |
| Rilpivirina (RPV) | Sin efecto | |
| INTR | Estavudina (d4T)** | |
| Zidovudina (ZDV) | | |
| Lamivudina (LAM o 3TC) | Sin efecto | |
| Abacavir (ABC) | Sin efecto | |
| Abacavir/lamivudina (ABC/LAM) | Sin efecto | |
| Abacavir/lamivudina/zidovudina (ABC/LAM/ZDV) | | |
| Didanosina (DDI) | | |
| Emtricitabina (FTC) | Sin efecto | |
| Tenofovir (TDF) | Sin efecto | |
| Emtricitabina/tenofovir (FTC/TDF) | Sin efecto |
| Inhibidor de Integrasa | Raltegravir (RAL) | Sin efecto |
| Inhibidores de Proteasa* | Indinavir (IDV)** | |
| Saquinavir (SQV) | | |
| Lopinavir/ritonavir (LPV/r) | | |
| Fosamprenavir (FPV) | | |
| Atazanavir (ATV) | /sin efecto | |
| Darunavir ó Etalonato de Darunavir | /sin efecto | |
| Inhibidor de Fusión/Entrada | Enfuvirtida (T-20) | Sin efecto |
| Maraviroc (MVC) | Sin efecto |
| *Todos los IP se refuerzan con ritonavir (su efecto ya considerado). **Medicamentos actualmente en desuso por su alta toxicidad o falta de potencia. |
Anexo II. Uso de Antirretrovirales para Prevenir la Infección del VIH
Profilaxis Pre Exposición al VIH
La profilaxis pre exposición (PrEP) es el uso oral de TDx/FTC por personas sin VIH antes de la exposición al virus para prevenir su transmisión. Desde 2012 la OMS recomendó considerar el uso de TDF o TDF/FTC como una intervención adicional para la prevención del VIH en parejas serodiscordantes, y para hombres y mujeres trans que tienen sexo con hombres. Desde 2015 la OMS recomienda ofrecer la PrEP como una opción adicional de prevención para las personas en riesgo considerable de infección por VIH como parte de enfoque de prevención combinada del VIH.
La OMS define un riesgo considerable como incidencias de VIH mayores al 3% persona/año. Estas incidencias se han identificado en algunos subgrupos de hombres que tienen sexo con hombres, mujeres trans y hombres heterosexuales y mujeres que tiene sexo con parejas con VIH no diagnosticadas o sin tratamiento. El riesgo individual varía dentro de las poblaciones claves, según el comportamiento individual y las características de las parejas sexuales, por lo que es importante priorizar la evaluación individual de riegos y no sólo el grupo poblacional para la oferta de PrEP.
En México, la Encuesta de prevalencia e infecciones recientes por VIH entre hombres que tienen sexo con hombres arrojó incidencias nacionales de VIH en HSH que acuden a sitios de encuentro del 6.2% persona/año (IC 95% 4.4 7.9), siendo el noreste la región con la menor incidencia (3.5%; IC 95% 0 7.1) y el centro la región con la mayor incidencia (11.6%; IC 95% 6.6 16.6).
Múltiples ensayos clínicos han confirmado la eficacia del uso de tenofovir (sólo o en combinación con emtricitabina) para prevenir la transmisión del VIH en parejas serodiscordantes (Partners PrEP), hombres que tienen sexo con hombres (iPrEX), hombres heterosexuales (TDF2), mujeres (TDF2), mujeres trans (iPrEX) y personas que se inyectan drogas. Un metanálisis de 10 de ensayos clínicos que compararon PrEP con placebo demostró una reducción del 51% en el riesgo de infección por VIH para PrEP versus placebo.
Cuando los estudios se estratificaron según el modo de exposición: rectal, vaginal o peneana, la PrEP mostró una eficacia similar, con un riesgo relativo del 0.34 (IC 95% 0.15 0.80; p=0.01) de infección por VIH para la PrEP en comparación con el placebo para la exposición rectal, y del 0.54 (IC 95% 0.32 0.90; p=0.02) para la exposición peneana o vaginal. PrEP fue efectivo tanto para hombres como para mujeres, con un riesgo relativo de infección por VIH para la PrEP en comparación con el placebo del 0.57 (IC 95% 0.34 0.94; p=0.03) para mujeres y 0.38 (IC 95% 0.20 0.60; p=0.0001) para hombres.
El nivel de protección se correlaciona fuertemente con el nivel de adherencia, por lo que la profilaxis pre exposición debe ofrecerse como una opción de prevención adicional dentro de un paquete integral de servicios de prevención que incluya pruebas periódicas de detección del VIH, diagnóstico y tratamiento de otras infecciones de transmisión sexual, monitoreo de la salud sexual, tratamiento antirretroviral y monitoreo del control viral para las personas con VIH, acceso a condones y lubricantes, consejería para la reducción de riesgo, intervenciones de reducción del daño, que incluyan el acceso a jeringas estériles.
Elegibilidad par el uso de PrEP
La profilaxis pre exposición debe ofrecerse como una opción adicional a personas en parejas serodiscordantes hasta que la persona con VIH se encuentre en control viral, así como a personas de poblaciones clave como hombres y mujeres trans que tienen sexo con hombres y personas trabajadoras sexuales que en los últimos 6 meses hayan tenido alguno de los siguientes factores de riesgo: relaciones sexuales vaginales o anales sin condón con más de una persona, diagnóstico de ITS o haber utilizado PEP.
Tabla II-A. Cuestionario de evaluación previa para hombres y mujeres trans que tienen sexo con
hombres y personas trabajadoras sexuales
hombres y personas trabajadoras sexuales
| En los últimos 6 meses | | ||
| ¿Con cuántas personas tuvo relaciones sexuales vaginales o anales? | 0 1 2* 3+* hombres 0 1 2* 3+* mujeres | ||
| ¿Uso condón cada vez que tuvo relaciones sexuales? | Sí | No* | No sé* |
| ¿Tuvo alguna infección de transmisión sexual? | Sí* | No | No sé* |
| ¿Tiene alguna pareja sexual que viva con VIH? | Sí | No | No sé* |
| Si respondió Sí, ¿él o ella ha estado en TAR por 6 meses o más? | Sí | No* | No sé* |
| Si respondió Sí, ¿el tratamiento logró control viral? | Sí | No* | No sé* |
| En los últimos 3 días: | | | |
| ¿Ha tenido relaciones sexuales sin uso de condón con una persona con VIH sin tratamiento? | Sí** | No | No sé** |
| ¿Ha tenido síntomas de resfriado como dolor de garganta, fiebre, sudoración, ganglios inflamados, úlceras orales, dolor de cabeza o salpullido? | Sí*** | No | No sé |
| *Considerar ofrecer PrEP; ** Considerar ofrecer PEP; *** Considerar infección aguda de VIH Adaptado de: Herramienta de la OMS para la implementación de PrEP, disponible en apps.who.int/iris/bitstream/handle/10665/255889/WHO-HIV-2017.17-eng.pdf;jsessionid=9EDE20C85E816A79AF4F158530FCB867?sequence=1 | |||
Las incidencias de VIH entre las personas que solicitaron PrEP en los estudios observacionales fue mayor a lo esperado, e inclusive las incidencias de VIH en los grupos de control en los ensayos clínicos de PrEP fueron a menudo mayor a de lo previsto, por lo que se infiere que el solicitar PrEP es un indicador de riesgo sustancial.
El uso de pruebas más sensibles tiene múltiples ventajas, incluido un diagnóstico y tratamiento más tempranos del VIH, un mejor asesoramiento para las personas con infección aguda por VIH y la minimización del riesgo de resistencia a los medicamentos durante PrEP y PEP. Se prefieren pruebas rápidas de anticuerpos de 3° generación en el punto de atención que utilizan sangre completa obtenida por punción o flebotomía.
Tabla II-B. Indicaciones y contraindicaciones para el uso de PrEP
| Indicaciones | Contraindicaciones |
| Ser VIH negativo | Infección por VIH |
| Sin sospecha de infección aguda de VIH | Signos o síntomas de infección aguda por VIH, probable exposición reciente al VIH |
| Riesgo sustancial de infección por VIH | Estimación de depuración de creatinina < 60 ml/min |
| Sin contraindicación para el uso de TDF, TDS o FTC | Alergia o contraindicación a los componentes |
| Disposición a usar PrEP como se indica, incluyendo prueba regulares de VIH | |
Se recomienda realizar una prueba de creatinina sérica antes de comenzar la PrEP y semestralmente durante el uso de la PrEP. Considerar realizar esta prueba cada 3 meses si existen antecedentes de alguna comorbilidad asociada a daño renal como diabetes o hipertensión.
Se recomienda realizar una prueba de antígeno de superficie de la hepatitis B (HBsAg) antes de iniciar PrEP. Las personas con HBsAg detectable y alanina transaminasa (ALT) elevadas más del doble del límite superior normal o signos clínicos de cirrosis podrían beneficiarse del tratamiento a largo plazo para el VHB.
Se requiere brindar consejería sobre la importancia de la adherencia para que la PrEP sea efectiva. Se recomienda que la persona vincule la toma diaria del medicamento con un hábito diario (como despertarte, irse a dormir o una comida regular)
Las personas que comienzan la PrEP pueden presentar efectos secundarios en las primeras semanas de uso. Estos efectos secundarios incluyen náuseas, calambres abdominales o dolor de cabeza, son típicamente leves y autolimitados y no requieren la interrupción de la PrEP. Las personas que comienzan la PrEP y son advertidas de este síndrome de inicio pueden ser más adherentes, por lo que esta información debe de ser incluida durante la consulta.
Se debe informar a los usuarios de PrEP que esta alcanza protección hasta después de 7 días de uso. Las personas que reportan exposición al VIH antes de que se haya logrado la protección total contra la PrEP deben ser consideradas para PEP.
Procedimiento sugerido para la primera consulta
Es importante descartar la necesidad de PEP o la posibilidad de una infección aguda, por lo que siempre será necesario realizar una prueba de VIH antes de brindar PrEP y esta debe de realizarse cada tres meses mientras se toma PrEP.
Tabla II-C. Procedimiento para la primer consulta
| Intervención | Observaciones |
| Prueba de VIH | Exposición durante las últimas 72 horas al VIH, considerar PEP por 28 días y reevaluar |
| Creatinina sérica | Evaluar enfermedad renal pre-existente |
| Antígeno Hep B | Negativo: considerar vacuna; Positivo: evaluar tratamiento para Hep B |
| Ac Hep C | Positivo: considerar referencia para evaluación y tratamiento |
| VDRL | Diagnóstico y tratamiento de sífilis |
| Otras ITS | Diagnóstico sindrómico o pruebas y tratamiento de otras ITS |
| Prueba de embarazo | Guiar control prenatal y consejería de anticoncepción y concepción segura |
| Historial de vacunación | Hepatitis A, VPH, tétanos y meningitis |
| Consejería | Evaluar si hay riesgo sustancial Discutir las opciones de prevención Proveer condones y lubricante Discutir el deseo y disposición para usar PrEP Desarrollar un plan para el uso efectivo de PrEP y de salud sexual y reproductiva Evaluar intenciones reproductivas y ofrecer anti-concepción o consejería para concepción segura Evaluar violencia de pareja y de género Evaluar uso de sustancias y condiciones de salud mental Información sobre efectos secundarios Recordar que PrEP tarda 7 días para alcanzar efectividad |
Procedimiento sugerido para las consultas de seguimiento
Deberá tener seguimiento clínico y serológico estrictos.
Tabla II-D. Procedimiento para consultas de seguimiento
| Intervención | Observaciones |
| Confirmación de VIH negativo | Cada 3 meses (considerar en el 1° mes) |
| Hablar sobre efectos secundarios | Cada visita |
| Consejería breve sobre adherencia | Cada visita |
| Depuración estimada de creatinina | Cada 6 meses, a menos de que exista historia de alguna condición afectando la función renal, como DM o hipertensión, en cuyo caso se recomienda cada 3 meses |
| Ac Hep C | Cada 12 meses en HSH |
La PrEP está recomendada sólo durante los periodos de riesgo, por lo que esta puede suspenderse si la persona ya no está en riesgo y es probable que esta situación se mantenga. Estos períodos de riesgo se asocian a cambios en el estado civil, en el consumo de alcohol y drogas, abandonar la escuela o el hogar, migración, eventos traumáticos u otros eventos.
Al igual que con PEP, la PrEP puede descontinuarse 28 días después de la última exposición potencial al VIH si las personas no tienen un riesgo sustancial continuo de contraer el VIH.
Profilaxis Post Exposición al VIH
Algoritmo II-A. Algoritmo para la evaluación y tratamiento de posible exposición al VIH
Tabla II-E. Clasificación del riesgo no ocupacional
| Riesgo sustancial | Riesgo mínimo |
| · Exposición vaginal, rectal, oftálmica, oral u otra mucosa, piel no intacta o contacto percutáneo. · Con sangre, semen, secreción vaginal, secreción rectal, leche materna, o cualquier fluido que está visiblemente contaminado con sangre. · Cuando la fuente se conoce con VIH. | · Exposición vaginal, rectal, oftálmica, oral u otra mucosa, piel intacta. · Con orina, secreción nasal, saliva, sudor o lágrimas si no están visiblemente contaminadas con sangre. · Independientemente de si la fuente se conoce o se sospecha con VIH. |
Modificado de www.cdc.gov/hiv/pdf/programresources/cdc-hiv-npep-guidelines.pdf
Seguimiento
Cualquier TS que tenga un episodio de exposición potencial al VIH, reciba o no terapia profiláctica deberá tener seguimiento clínico y serológico estrictos.
Evaluación del riesgo de infección. En primer lugar, es importante determinar el estado serológico de la fuente. Si la fuente es seropositiva conocida, el protocolo establecido es vigente y debe seguirse. Si se determina por prueba rápida o estándar que la fuente es seronegativa, se recomienda suspender la profilaxis. Recordar las consideraciones ya señaladas acerca de aquellas personas fuente en que se sospeche periodo de ventana. Para el TS se deberá determinar una prueba de ELISA para VIH basal, para determinar las condiciones al momento del accidente. Si el TS es seronegativo, independientemente de la decisión de iniciar terapia profiláctica, se recomienda repetir la prueba a las 2 semanas de la exposición con seguimiento serológico a las 6, 12 y 24 semanas.
Evaluación de seguridad. Se requiere una evaluación clínica para determinar la tolerancia y adherencia del régimen a las 72 horas de iniciado, cuando hayan transcurrido 2 semanas y al término de la terapia. El monitoreo bioquímico se recomienda con BH, QS, PFH; a nivel basal, a los 15 días del inicio y al término de la terapia.
El TS debe ser asesorado para tomar las precauciones necesarias durante las 6 a 12 semanas postexposición para evitar una posible infección a otra persona: uso correcto del condón, evitar donar sangre u órganos, evitar la lactancia materna y el embarazo.
Tabla II-F. Pruebas de monitoreo recomendadas para personas expuestas al VIH
| Detección de: | Fuente | Persona expuesta | |||
| Basal | Basal | 4-6 semanas | 3 meses | 6 meses | |
| Para todas las personas por cualquier exposición | |||||
| VIH | | | | | |
| VHB | | | | | |
| VHC | | | | | |
| | Para todas las personas por exposición sexual | ||||
| Sífilis | | | | | |
| Gonorrea | | | | | |
| Clamidia | | | | | |
| Embarazo en mujeres | | | | | |
| | Personas con TDF/FTC | ||||
| Creatinina sérica | | | | | |
| TGO/TGP | | | | | |
| En ningún caso se debe de retrasar el inicio de la profilaxis por no contarse con pruebas serológicas | |||||
Modificado de www.cdc.gov/hiv/pdf/programresources/cdc-hiv-npep-guidelines.pdf
Pruebas de laboratorio para el monitoreo de personas expuestas al VIH. Se requieren pruebas de laboratorio para: 1) documentar el estado de la infección por VIH de la persona que se presenta para la evaluación para PEP (y la fuente de exposición cuando esté disponible y si concedió una autorización), 2) identificar y manejar clínicamente cualquier otra condición potencialmente resultantes de la exposición a fluidos corporales potencialmente infectados, 3) identificar cualquier condición que pueda afectar al régimen de medicación de la PEP, y 4) el seguimiento de la seguridad o toxicidades relacionadas con el régimen prescrito (Tabla II-F).
Adherencia al régimen PEP y visitas de seguimiento
Se han observado problemas en mantener la adherencia de dosis diarias de ARV durante 28 días en la mayoría de las poblaciones y en el cumplimiento de la visita de seguimiento para realizar la segunda prueba de VIH y otros servicios, particularmente en personas en PEP por violencia sexual.
Una revisión sistemática de 34 estudios de PEP en poblaciones que no incluían violencia sexual, y 26 estudios en personas en PEP por violencia sexual, encontró que la tasa de personas que completaron el estudio fue menor en las personas que habían sufrido violencia sexual (40.2% [95% CI = 31.2%, 49.2%]) y mayor en las personas que presentaron otra exposición no ocupacional (65.6% [95% CI = 55.6%, 75.6%]).
Un estudio para medir la adherencia encontró una proporción de pacientes adheridos al día 28 del 29% en pacientes a los que se les brindó un paquete inicial de medicamentos para 4-7 días, mientras que al grupo que se le proporcionó un suministro de 28 días la proporcionó de pacientes adheridos al día 28 fue de 71%.
Entre las razones para abandonar la PEP se encuentran efectos adversos, interferencia con la rutina, incapacidad de tomar tiempo fuera del trabajo o la escuela, y la reconsideración del riesgo de VIH.
Un estudio en HSH encontró tasas de adherencia superiores en pacientes en esquemas basados en TDF/FTC en dosis fija con o sin RAL (57% con RAL, 72.7% sin RAL) en comparación con los esquemas basados en ZDV/3TC y un IP reforzado con ritonavir (46%). En el caso de los pacientes en el esquema TDF/FTC+RAL el 57% informó tomar sus medicamentos, y un 27% adicional tomó sus medicamentos una vez al día, pero a veces perdió la segunda dosis diaria.
Profilaxis post-exposición no ocupacional al VIH
La evidencia de disminución de la trasmisión de VIH después de exposición ocupacional o después de exposición perinatal ha hecho considerar el beneficio de la profilaxis posterior a la exposición no ocupacional. En este apartado de exposición no ocupacional se incluye la exposición sexual, incluyendo violencia sexual.
La profilaxis post-exposición no ocupacional está recomendada en personas con riesgo sustancial al VIH que incluye: transfusión sanguínea (9,250 casos de VIH por 100 mil exposiciones), uso de jeringas no estériles (63 casos de VIH por 100 mil exposiciones), pinchazo percutáneo (23 casos de VIH por 100 mil exposiciones), coito anal receptivo (138 casos de VIH por 100 mil exposiciones), penetración vaginal receptiva (8 casos de VIH por 100 mil exposiciones), coito anal insertivo (11 casos de VIH por 100 mil exposiciones), penetración vaginal insertivo (4 casos de VIH por 100 mil exposiciones), sexo oral receptivo (bajo), sexo oral con penetración (bajo).
La profilaxis post-exposición no ocupacional no está recomendada en personas que buscan atención posterior a las 72 horas del riesgo sustancial, o en personas con riesgo insignificante al VIH que incluye: mordidas, escupitajos, aventar fluidos corporales si no se observan contaminados por sangre (incluyendo semen o saliva), compartir juguetes sexuales.
La efectividad de la profilaxis postexposición no ocupacional requiere de una rápida evaluación inicial que incluya: la determinación del estado de VIH de la persona potencialmente expuesta, el momento y las características de la exposición más reciente, la frecuencia de la exposición, el estado serológico de la fuente (si es posible) y la probabilidad de infección concomitante con otros patógenos. Toda esta información debe de utilizarse para evaluar si la PEP está indicada.
1. Estado de la persona potencialmente expuesta: es importante realizar una evaluación inicial del estado de VIH que permita identificar la infección por VIH previa, no documentada. Los profesionales
de la salud deben evaluar la probabilidad de infecciones de transmisión sexual, infecciones transmitidas por agujas no estériles (por ejemplo, hepatitis B o hepatitis C), y el embarazo en mujeres.
2. Momento y frecuencia de la exposición: Se considera que la utilidad de la profilaxis postexposición es pobre cuando han pasado más de 72 horas. En los casos en que se trate de exposiciones frecuentes y recurrentes no se debería considerar la profilaxis postexposición, sino orientar a intervenciones sobre reducción de riesgo.
3. Estado de VIH de la fuente: Si la exposición ocurre con una persona conocida con VIH, debe intentarse entrevistarla para conocer información sobre su historia de antirretrovirales y última determinación de carga viral. Si la exposición ocurre con una persona de la cual se desconoce su estado de VIH debe evaluarse la posibilidad de que la persona esté disponible para realizarle serología de VIH. Si la exposición hace considerar un riesgo elevado, puede iniciarse el tratamiento y reevaluar posteriormente si se obtiene serología de la persona fuente.
Se recomienda un ciclo de 28 días de PEP para personas sin VIH, que buscan atención en las primeras 72 horas después de una exposición no ocupacional a sangre, secreciones genitales, u otros fluidos corporales potencialmente infectados de personas que se conoce viven con VIH o de estado serológico desconocido al que la exposición representa un riesgo importante para la adquisición del VIH. Dado que la adherencia es crítica para la eficacia de la PEP, es preferible seleccionar regímenes que minimicen los efectos secundarios, el número de dosis por día y el número de pastillas por dosis.
Tabla II-G. Esquemas preferentes y alternativos para la profilaxis post-exposición no ocupacional al
VIH de 28 días en personas con 13 años o más
VIH de 28 días en personas con 13 años o más
| Grupo de edad | Esquema | |
| Personas >13 años de edad con función renal normal (incluidas embarazadas) | Preferente | TDF/FTC/EFV |
| TDF/FTC + RAL o DTG* | ||
| Alternativo | TDF/FTC + Etalonato de Darunavir+r | |
| Personas >13 años de edad con disfunción renal (incluidas embarazadas) | Preferente | ZDV/3TC + RAL o DTG* |
| Alternativo | ZDV/3TC + Etalonato de Darunavir+r | |
| TDF: tenofovir; FTC: Emtricitabina; ATV: atazanavir; RTV: ritonavir; LPV/r: lopinavir potenciado con ritonavir; EFV: efavirenz * No recomendado en personas con coinfección con hepatitis B, tuberculosis y contraindicado en mujeres con potencial de embarazo (el análisis preliminar no programado de un estudio observacional en curso en Botswana, encontró 4 casos de defectos del tubo neural en mujeres que quedaron embarazadas mientras tomaban DTG 0.9% vs. 0.1% de riesgo de defectos del tubo neural en bebés nacidos de mujeres que toman otros ARV en el momento de la concepción). | ||
Exposición no ocupacional al VIH en niños y niñas
En el caso de niñas, niños y adolescentes, las situaciones de exposición pueden ser las siguientes: accidente domiciliario con objetos punzocortantes de personas VIH positivas (ej. rastrillos, agujas); accidente hospitalario con agujas provenientes de personas con VIH o de origen desconocido; exposición sexual: violación sexual o contacto sexual consentido; leche materna proveniente de nodriza con VIH; heridas por mordedura humana por persona con VIH y trasplantes.
El riesgo de transmisión del VIH de exposición no ocupacional, no perinatal, es generalmente bajo y depende del tipo de exposición, tipo de fluido y estado serológico de la fuente. Excepto por la exposición perinatal, ningún estudio ha demostrado la seguridad y eficacia de la utilización postexposición de antirretrovirales para estos casos. Hasta el momento, no hay reportes confirmados de adquisición de VIH por lesiones percutáneas por aguja hallada en la comunidad.
El riesgo de transmisión de VIH por la leche materna está asociado con el estadio de infección en la madre y duración de la alimentación con la leche materna. Si la mujer adquiere el VIH después del nacimiento, el riesgo de transmisión de VIH por alimentación con leche materna es del 29% (6-42%). En mujeres con infección crónica, el riesgo de transmisión se estima entre 10 a 16%. El riesgo acumulativo de transmisión si administra leche materna por 5, 11,17 y 23 meses fue de 3.5%, 7%, 8.9% y 10.3%. El riesgo por episodio de administración de leche materna a una sola exposición se estima en 0.001% a 0.004%. Hasta el momento no hay reportes de transmisión de VIH a un lactante con una sola exposición enteral a la leche de una mujer con infección por el VIH.
La transmisión de VIH por mordeduras humanas se ha descrito, pero este tipo de transmisión es muy raro, aun cuando la saliva esté contaminada con la sangre de quien mordió. En ausencia de sangre en saliva y sangre en el sitio de la mordida la PPE no está indicada; sin embargo, si hay intercambio de sangre entre quien mordió y a quien mordieron, debe de ser considerado el riesgo de transmisión de VIH y considerar el inicio de PPE, ya que está indicada cuando hay exposición significativa a heridas profundas y sangrantes en personas con VIH.
Aunque puede considerarse iniciar la PPE en varias circunstancias, principalmente se recomienda cuando hay exposición de alto riesgo de personas conocidas con infección por el VIH y administrar por 28 días.
Por no estar disponibles en México las formulaciones pediátricas de algunos antirretrovirales para profilaxis post exposición no ocupacional al VIH, se recomienda administrar los medicamentos que se mencionan en la Tabla II-H.
Tabla II-H. Esquemas preferentes y alternativos para la profilaxis post-exposición no ocupacional al
VIH en personas con menos de 13 años
VIH en personas con menos de 13 años
| Edad | Recomendación | |
| 2 a <13 años | Preferente | ZDV + XTC + RAL |
| Alternativo | ZDV + XTC + LPV/r o TDF + FTC + LPV/r o RAL | |
| 4 semanas <2 años | Preferente | ZDV + 3TC + LPV/r o ZDV + 3TC + RAL |
| Alternativo | ZDV + FTC + RAL o ZDV + FTC + LPV/r | |
| XTC: emtricitabina o lamivudina; 3TC: Lamivudina; ZDV: Zidovudina; LPV/r: lopinavir potenciado con ritonavir; RAL: raltegravir; FTC: emtricitabina | ||
Víctimas de violencia sexual
Tabla II-I. Lineamientos a seguir por el equipo de salud al atender a víctimas de violencia sexual
| Intervención | Observaciones |
| Intervención psicológica | Apoyo psicológico. Consejería. Se recomienda consultar la Guía de Salud Sexual y Reproductiva para Mujeres y VIH del Centro Nacional de Equidad y Género y Salud Reproductiva. |
| Historia clínica | Evaluación del riesgo. Consentimiento informado. |
| Exploración física | Dependerá del estado emocional de la persona. Evitar siempre causar mayor daño físico o nuevas lesiones durante la exploración física. Examen anal y/o vaginal. La exploración física puede realizarse en forma completa después de 72 horas si la persona está en mejores condiciones. Atención de lesiones graves. |
| Toma de muestras de laboratorio | · Sangre para la determinación de VIH, sífilis. · Secreciones vaginales y orales (si tiene menos de 24 horas) para cultivo de Chlamydia, gonorrea, vaginosis bacteriana. · Prueba de embarazo (mujeres en edad fértil). · Muestra de orina si se dispone de ella. |
| Tratamiento preventivo de VIH y ITS | Ver tabla II-G y II-H. |
| Tratamiento preventivo para embarazo | Ver tabla 40. |
| Asesoría jurídica | Canalización a los servicios correspondientes para denuncia si lo desea la paciente |
| En ningún caso se aplazará el inicio de la profilaxis postexposición por no contar con pruebas serológicas. | |
Conviene tener en cuenta el momento en que se presenta la persona, antes o después de 72 horas, pues de eso dependen las acciones a realizar. A continuación, se enuncian los lineamientos básicos a seguir por el equipo de salud.
El tratamiento con agentes antirretrovirales en estas circunstancias disminuye la tasa de transmisión de VIH entre 70 y 80%. Se desconoce la incidencia de la transmisión de VIH después de contacto sexual aislado con una persona seropositiva, pero se estima que es de 1 a 2 casos por cada 1,000 después de la penetración vaginal, y de 1 a 3 casos por cada 100 después de la penetración anal. El riesgo aumenta con una etapa superior de la infección por VIH y una carga viral más alta en el agresor y con la presencia de un traumatismo genital o úlceras genitales.
Para el caso de las personas migrantes en quienes informen ser portadoras de VIH o sida, deberán ser manejadas una vez en territorio nacional. Deberán ser canalizadas al servicio de atención más cercano para personas que viven con VIH de acuerdo con la ruta de tránsito en que se encuentren y de acuerdo con las recomendaciones de manejo antirretroviral de la presente guía durante el tiempo en que se encuentre en el país
Población especial: migrantes
La migración es uno de los fenómenos sociales más complejos en el mundo, debido a que está relacionado con diversos aspectos económicos, políticos, sociales y culturales. México presenta una gran diversidad de población en movimiento, situándose como un país receptor, de tránsito y de origen de migrantes. Por ello, es de gran importancia nacional la suma de esfuerzos desde diferentes ámbitos para favorecer la salud de las personas que migran en busca de mejores condiciones de vida.
La movilidad de las personas migrantes constituye en sí misma un reto para la vigilancia epidemiológica y para la salud pública, además de que la población migrante es un grupo vulnerable en clara desventaja social y con mayores riesgos de salud, entre ellos la infección por VIH. Esa vulnerabilidad no es inherente a las personas migrantes, sino producto de las condiciones de desigualdad social del proceso migratorio mismo.
Considerando que en la población migrante hay personas que viven con VIH a quienes se les ha otorgado el TAR durante su travesía, o bien que su condición las coloca en riesgo de sufrir violaciones, las intervenciones que se plantean son las siguientes:
1. Atender de manera ágil a las víctimas de violencia sexual, principalmente a mujeres, niños y niñas.
Los servicios de salud reproductiva se brindarán otorgando de manera expedita la profilaxis de VIH e ITS y prevención de embarazos con anticoncepción de emergencia.
2. Servicios de atención de VIH en forma temporal y otras ITS.
Algoritmo II-B. Flujograma de atención del paciente migrante

Profilaxis post-exposición ocupacional al VIH
En estudios prospectivos de trabajadoras y trabajadores de la salud, el riesgo promedio de adquisición de la infección por el VIH posterior a una exposición percutánea con sangre contaminada, se estima del 0.3% (IC 95%= 0.2-0.5%) y posterior a una exposición en mucosas del 0.09% (IC 95%=0.006%-0.5%).
El riesgo de transmisión posterior a una exposición con otros fluidos o tejidos contaminados, diferentes a la sangre, no ha sido cuantificado, pero es probable que sea considerablemente menor que la exposición a esta última. Las siguientes recomendaciones están dirigidas al personal de salud (médicos, médicas, personal de enfermería, dental, químico, empleadas y empleados, estudiantes o personal voluntario) que ha sido expuesto a sangre o fluidos corporales potencialmente contaminados con el VIH, VHB o VHC durante el desempeño de sus actividades profesionales (exposición ocupacional). El riesgo de adquirir la infección por VIH, VHB y/o VHC a través de la exposición ocupacional, varía dependiendo de los siguientes factores:
1. Tipo, mecanismo y gravedad del accidente:
Los fluidos corporales que se consideran potencialmente infecciosos son: sangre y sus derivados, LCR, líquido sinovial, pleural, peritoneal, pericárdico y amniótico. Si bien el semen y secreciones vaginales han sido implicados en la transmisión sexual del VIH, no se han asociado a la transmisión ocupacional. Las secreciones nasales, saliva, esputo, sudoración, lágrimas, vómito, orina y heces no se consideran potencialmente infecciosos, salvo que contengan sangre visible.
El riesgo varía de acuerdo con el dispositivo con el que se produce la lesión, siendo éste mayor cuando el accidente sucede con una aguja hueca visiblemente contaminada con sangre de la persona fuente, si el procedimiento practicado fue la colocación de la aguja en una vena o arteria, y/o si se ocasionó una herida profunda en la o el trabajador de la salud (TS). También se han reportado casos secundarios a laceración con objeto cortante. Otros factores que aumentan el riesgo de transmisión son la exposición de piel y mucosas no íntegras a sangre o fluidos corporales potencialmente contaminados con el VIH (ej., dermatitis, abrasiones o laceraciones).
2. Características de la fuente:
Si no se conoce el estado serológico de la persona fuente o existe un resultado serológico no reactivo con sospecha clínica elevada, debe considerarse que existe riesgo potencial de que ésta sea VIH-positiva o en periodo de ventana.
El riesgo se incrementa cuando se conoce que la persona tiene diagnóstico confirmado de VIH, VHB y/o VHC, o en caso de que él o la paciente fuente tenga carga viral de VIH detectable con o sin tratamiento antirretroviral.
Exposición ocupacional al VIH en trabajadoras y trabajadores de la salud: prevención y profilaxis postexposición
Las recomendaciones de uso de medicamentos antirretrovirales para prevenir la infección por el VIH luego de una exposición ocupacional se presentan en tabla II-B. Si se decide administrar profilaxis postexposición (PPE), deberá iniciarse lo más temprano posible. La utilidad del tratamiento es cuestionable si han transcurrido más de 72 horas.
La duración de la terapia deberá ser de 4 semanas, y el clínico debe insistir en la importancia de alcanzar una adecuada adherencia y terminar el tratamiento para lograr el objetivo inicial. Es importante recordar que aproximadamente 50% de los TS presentarán al menos un efecto adverso asociado al TAR, por lo que estos deberán ser tomados en consideración a la hora de elegir el esquema y advertir al TS de su posible presentación. En caso de requerirlo, modificar el tratamiento.
Se ha documentado la transmisión ocupacional de cepas resistentes. En el caso de que se conozca o se sospeche la presencia de cepas resistentes en la persona fuente (persona con CV >1,000 copias/ml en presencia de TAR o progresión de la enfermedad), debe considerarse la inclusión de dos fármacos activos (valorar historia de tratamiento ARV y de existir, los resultados de ensayos de resistencia de la fuente).
Recomendaciones para la selección del régimen de PPE
La selección del esquema ARV con fines de profilaxis postexposición debe poner en la balanza el riesgo de adquisición por el VIH y el potencial de toxicidad asociada a los medicamentos. No hay un esquema único que pueda ser recomendado como profilaxis (ver tabla II-F).
Tabla II-J. Esquemas preferentes y alternativos para la profilaxis post-exposición ocupacional al VIH
de 28 días
de 28 días
| Personas candidatas para profilaxis | · Personas con exposición percutánea a una aguja que haya sido utilizada intramuscular o intravenosamente con una persona conocida con VIH o con estado serológico desconocido y factores de riesgo para VIH. · Personas con exposición percutánea a dispositivos intravasculares o lesiones con objetos cortantes de personas que viven con VIH o con estado serológico desconocido y factores de riesgo para VIH. · Personas con exposición en mucosas o en piel no intacta, a fluidos potencialmente infecciosos de una persona que vive con VIH o con estado serológico desconocido y factores de riesgo para VIH. |
| Tiempo de inicio de TAR | Suspender actividad laboral, aseo exhaustivo de la región y exprimir la zona de la herida, e iniciar tratamiento preferentemente dentro de las primeras 2 h. Mientras más tiempo pase, disminuye la eficacia de la prevención. Después de las 72 h no se recomienda. |
| Esquemas recomendados | Ver tabla II-G y II-H |
| Duración del tratamiento | 28 días |
| Seguimiento serológico | Basal, 6, 12 y 24 semanas |
| * De preferencia, iniciar el tratamiento profiláctico en el sitio de trabajo | |
Tabla II-K. Manejo de enfermedades de transmisión sexual prevenibles
| Enfermedad a prevenir | Manejo |
| Hepatitis B | Gamaglobulina hiperinmune específica a razón de 0.065 ml/kg de peso vía intramuscular (si se dispone de ella). Vacunación inmediata contra hepatitis B (si previamente está vacunada/o solo una dosis de refuerzo y, si no, un esquema completo). Sin contraindicación durante el embarazo. |
| Gonorrea y Clamidia | Ceftriaxona 250 mg IM, Azitromicina 1 gr dosis única Alternativa: En caso de estar embarazada: Ceftriaxona 1 gr IM y Ciprofloxacina 500 mg en caso de alérgica o contraindicación a la Azitromicina. |
| Gardnerella vaginalis | Metronidazol 2 gr VO dosis única. |
| Infección por VIH | Ver tabla II-G |
La incidencia de la mayoría de las infecciones de transmisión sexual en los niños y niñas después del abuso sexual es baja; las niñas pre púberes parecen tener un menor riesgo de infección ascendente que las mujeres adolescentes o adultos.
La identificación de un agente patógeno de transmisión sexual en un niño después del período neonatal sugiere, en la mayoría de los casos, abuso sexual. Sin embargo, hay excepciones: por ejemplo, la infección rectal o genital con C. trachomatis en niños y niñas puede originarse a partir de una infección contraída en el período perinatal que puede persistir hasta los tres años.
La profilaxis se recomienda cuando no se realizan pruebas de laboratorio, posiblemente no regrese el menor para administrar tratamiento si se detecta ITS o el riesgo de infección es elevado, ej. el perpetrador vive con VIH.
Tabla II-L. Manejo de las ITS en niños y niñas
| Enfermedad a prevenir | Manejo |
| Hepatitis B | Gamaglobulina hiperinmune específica a razón de 0.065 ml/kg de peso vía intramuscular (si se dispone de ella) Comenzar o completar la vacunación en formar inmediata |
| Gonorrea y Clamidia | < 45 kg Ceftriaxona 125 mg IM, DU Alternativa: cefixima: 8 mg/kg VO, DU (máximo 400 mg) > 45 kg Ceftriaxone 250 mg IM DU + < 45 kg Azitromicina 20 mg/kg máximo 1 gr VO, DU > 45 kg Azitromicina 1 gr VO, DU |
| Tricomoniasis | < 45 kg Metronidazol 15 mg/kg/d cada 8 hr VO, por 7 días (dosis máxima 2 g) > 45 Kg 2 gr VO, DU |
| Infección por VIH | ver tabla II-C |
| Papilomavirus* | Vacuna contra papilomavirus > 9 años de edad |
| VO: vía oral; DU: dosis única * protege contra serotipos aún no adquiridos | |
Anexo III. Abordaje de otras infecciones en personas con VIH
Tratamiento y profilaxis de las Infecciones Oportunistas (IO)
A partir de la introducción del TAR a mediados de los años noventa, el riesgo relativo de enfermedades asociadas a inmunocompromiso grave, tales como la infección por citomegalovirus, Pneumocystis jirovecii, Toxoplasma gondii, Mycobacterium avium complex, etcétera, ha disminuido hasta 10 veces en poblaciones con acceso a los antirretrovirales.
El riesgo de desarrollar una IO es el resultado de la supresión viral duradera (<50 copias/ml) y la consecuente reconstitución del sistema inmunológico. La mayoría de las IO ocurren cuando el conteo de linfocitos CD4 es menor a 200 células/mm3.El riesgo de desarrollarlas persiste en los primeros meses posteriores al inicio del tratamiento antirretroviral y con frecuencia es inversamente proporcional al nadir del conteo de células CD4.
Actualmente, la mayoría de los casos de IO se presentan en personas que desconocen ser VIH positivas, en personas que no responden virológica o inmunológicamente al TAR, o en poblaciones vulnerables que no cuentan con acceso regular a servicios de salud.
A pesar de que las IO han disminuido en México y en toda América Latina, aún son la principal causa de incapacidad, hospitalización y muerte en personas que viven con VIH. Es imprescindible promover el diagnóstico oportuno de las IO, así como incrementar el conocimiento acerca de su prevención, diagnóstico y tratamiento entre el personal médico tratante, dentro y fuera de clínicas especializadas, así como facilitar el inicio temprano y mantenimiento supervisado del TAR.
Por todo lo anterior, el uso de medicamentos para la profilaxis de una IO es indispensable para reducir el riesgo de estas complicaciones. Desde 1995, se han elaborado guías para la prevención de las IO, las cuales se deben adaptar a la situación y condiciones de la población donde se lleva a cabo la intervención.
La tabla III-A indica estrategias terapéuticas recomendadas para las IO activas más frecuentes. Las tablas III-B y III-C muestran las opciones farmacológicas y dosis utilizadas para la profilaxis primaria y secundaria de las principales IO.
Tabla III-A. Tratamiento de infecciones oportunistas activas
| Enfermedad | Tratamiento de elección | Tratamiento alternativo | Recomendaciones |
| Neumonía por Pneumocystis jirovecii (PCP) | Enfermedad moderada a severa: · TMP/SMX: TMP 15 a 20mg/kg y SMX 75 a100mg/kg IV c/6 u 8h (AI) puede cambiarse a VO después de la mejoría clínica. Duración del tratamiento 21 días. (AII) · En niñas/os > 2 meses - TMP 3.75 a 5 mg/kg/dosis y SMX 19 a 25 mg/kg/dosis cada 6h.(AI) Enfermedad leve a moderada: · TMP 15 a 20mg/kg y SMX 75 a 100mg/kg VO dividida en 3 dosis. (AI) · TMP-SMX (160/800mg) 2 tab c/8h.(AI) · Duración del tratamiento 21 días.(AII) | Enfermedad moderada a severa: · Pentamidina* 4mg/kg IV c/24 h infundida en 60min, (AI) se puede reducir la dosis a 3mg/kg para reducir toxicidades. (BI) · Primaquina 15 a 30mg VO c/24 h + Clindamicina 600 a 900mg IV c/6 u 8ho Clindamicina 300 a 450mg VO c/6 u 8 h. (AI) Enfermedad leve a moderada: · Dapsona 100mg VO c/24 h + TMP15mg/kg/día VO (3 dosis). (BI) · Primaquina 15 a 30mg VO c/24 h + Clindamicina 300 a 450mg c/6 u 8h.(BI) · Atovacuona* 750mg VO c/12 h con alimentos.(BI) | Indicaciones para administrar de esteroides: (AI) · Pa02<70mmHg al aire ambiente o gradiente alveolo-arterial de 02>35mmHg · Prednisona dosis: Comenzando en las primeras 72 hrs del tratamiento para PCP. (AI) · Día 1 a 5: 40mg VO c/12 h · Día 6 a 10: 40 mg VO c/24 h · Día 11 a 21: 20 mg VO c/24 h En niñas/os · Prednisona del 1° al 5°día, 1mg/kg/dosis c/12 h; 0.5 mg/kg/dosis c/12 h del día 6 al 10; y del día 11 al 21 0.5 mg/kg/dosis c/24 h.(AI) · Metilprednisolona puede ser administrada al 75% de la dosis de prednisona. · El beneficio de iniciar esteroides después de 72h es incierto, pero se puede usar en pacientes con enfermedad moderada a severa. (BIII) · Antes del uso de primaquina se debe realizar prueba para deficiencia de glucosa 6 fosfatodeshidrogenasa (G6PD). |
| Candidiasis (mucosas) | Candidiasis orofaríngeas: Episodios iniciales (Tx por 7 a 14 días) · Fluconazol 100mg c/24 h VO. (AI)Niñas/os: 6-12 mg/kg/dosis cada 24 h. (AI) · Clotrimazol 10mg VO 5 veces al día. (BII) · Nistatina en suspensión 4-6ml c/6h o 1-2 tab c/6 h. (BII) · Miconazol 1 tab mucoadhesiva c/24h VO. (BII) Candidiasis esofágica: Tiempo de tratamiento 14 a 21 días · Fluconazol 100mg c/24h (hasta 400mg) VO o IV. (AI) Niñas/os: 6 a 12 mg/kg/dosis cada 24h por 3 semanas. (AI) · Itraconazol solución oral 200mg c/24h VO. (AII) Niñas/os: 2.5 mg/kg/dosis c/12 h por 3 semanas. (AII) Candidiasis vulvovaginal: · Fluconazol 150mg DU VO. (AII) · Azoles tópicos (clotrimazol, butoconazol, miconazol, tioconazol) 3 a 7 días. (AII) Candidiasis orofaríngea, esofágica refractaria a fluconazol: · Itraconazol solución oral >200mg c/24 h VO. (AII) Niños: 2.5 mg/kg/dosis c/12 h (máx. 200 a 400 mg/día) VO. (AII) · Posaconazol solución oral 400mg c/12 h VO. (AII) Candidiasis vulvovaginal recurrente o severo · Fluconazol 150mg c/72h por 3 dosis. (AII) · Antifúngicos tópicos >7 días. (AII) | Candidiasis orofaríngeas: Episodios iniciales (Tx por 7 a 14 días) · Itraconazol solución oral 200mgc/24 h VO. (BI) · Posaconazol solución oral 400mg c/12 h 1 día y posteriormente 400mg c/24 h. (BI) Candidiasis esofágica: Tiempo de tratamiento 14 a 21 días · Voriconazol 200mg c/12 h VO o IV. (BI) · Posaconazol 400mg c/12 h VO (BI) · Caspofungina 50mg c/24 h IV. (BI) En niños de 3 meses a 17 años: 70 mg/m2SC dosis inicial y continuar con 50 mg/m2SC al día (máx. 70 mg/día). (BI) · Micafungina 150mg c/24 h IV. (BI) · Anidulafungina 100mg IV DU posteriormente 50mg c/24 h IV. (BI) En niños/as de 2 a 17 años, dosis inicial de 3 mg/kg/día y continuar a 1.5 mg/kg/día. (BI) · Anfotericina B deoxicolato 0.6mg/kg c/24 h IV. (BI) Candidiasis vulvovaginal no complicada: · Itraconazol solución oral 200mgc/24 h VO por 3 a 7 días. (BII) Candidiasis orofaríngea, esofágica refractaria a fluconazol: · Anfotericina B deoxicolato 0.3 mg/kg c/24 h IV. (BII) En niños la dosis 0.3 a 0.7 mg/kg/día IV. (BII) · Anfotericina lipídica 3 a 5mg/kg c/24 h IV. (BII) · Anidulafungina 100mg VI DU y posteriormente 50mg c/24 h IV. (BII) · Caspofungina 50mg c/24 h IV. (CII) · Micafungina 150mg c/24 h IV. (CII) · Voriconazol 200mg c/12 h IV o VO. (CIII) | · El tratamiento prolongado con azoles puede promover el desarrollo de resistencias. · Se ha reportado alto índice de recaída de candidiasis esofágica con equinocandina más que con fluconazol. |
| Criptosporidiosis | · Iniciar TAR para recuperación inmune sostenida. (AII) · Tratamiento sintomático para diarrea. (AIII) · Rehidratación agresiva VO o IV y remplazo de la pérdida de electrolitos. (AIII) · Nitazoxanida 500 a 1,000mg VO c/12 h con alimentos por 14 días. (CIII) Niñas/os: Duración 3-14 días. (BII) · 1-3 años: 100 mg cada 12 h con los alimentos · 4-11 años: 200 mg cada 12 h con los alimentos · Mayores de 12 años: 500 mg cada 12 h con los alimentos | · Paramomicina* 500 mg (25-35 mg/kg) c/6 h durante 4 semanas y 500 mg c/12 h durante 4 semanas más. | · Uso de agentes antimotilidad tales como loperamida o tintura de opio puede aliviar los síntomas. (BIII) |
| Isosporidiasis | · TMP/SXZ 160/800 mg VO/IV c/6 h durante 10 días y continuar 160/800 mg c/12 h durante 10 a 14 días. (AI) Niñas/os: · TMP/SXZ 5 mg/kg/día c/12 h por 10 días. (AI) · Iniciar TAR para recuperación inmune sostenida. (AII) · Tratamiento sintomático para diarrea. (AIII) · Rehidratación agresiva VO o IV y remplazo de la pérdida de electrolitos. (AIII) | · Tratamiento farmacológico durante 7-10 días para cualquiera de las opciones: - Ciprofloxacino 500 mg VO c/12 h(BII) - o Roxitromicina 2.5 mg/kg de peso c/12 h(CII) - o Nitazoxanida 500 mg VO c/12 h(CII) Niñas/os: · Ciprofloxacino es 10-20 mg/kg/día c/12 h por 7 días · Nitazoxanida: · 1-3 años: 100 mg c/12 h con los alimentos · 4-11 años: 200 mg c/12 h con los alimentos · Mayores de 12 años: 500 mg c/12 h con los alimentos. (BII) | · Uso de agentes antimotilidad tales como loperamida o tintura de opio puede aliviar los síntomas. (BIII) |
| Infecciones por Histoplasma capsulatum | Enfermedad diseminada moderada a grave: · Tx inducción: durante 2 semanas o hasta que haya mejoría clínica, Anfotericina B liposomal 3mg/kg c/24 h IV. (AI) · Tx mantenimiento: Itraconazol 200mg VO c/8h por 3 días y después c/12 h.(AII) En niñas/os: · Itraconazol 2 a 5mg/kg/dosis 3 veces al día los primeros 3 días, después 2 a 5 mg/kg por dosis cada 12 h por 12 meses. (AII) Enfermedad diseminada leve: · Tx inducción y mantenimiento: Itraconazol 200mg c/8h VO por 3 días y luego 200mg c/12 h VO. (AII) Duración del tratamiento: 12 meses. En niñas/os: · Itraconazol 2-5mg/kg/dosis 3 veces al día los primeros 3 días, después 2-5 mg/kg por dosis cada 12 h por 12 meses. (AII) Tratamiento para Meningitis: · Tx inducción: (4 a 6 semanas) Anfotericina liposomal 5mg/kg/día. (AII) · Tx de mantenimiento: Itraconazol 200mg c/12 h por 1 año y hasta la resolución de hallazgos anormales de LCR. (AII) | Enfermedad diseminada moderada a severa: · Tx inducción: (2 semanas o hasta la mejoría clínica) Anfotericina B deoxicolato 0.7mg/kg c/24 h IV. (BI) · Anfotericina B complejo lipídico 5mg/kg IV c/24 h. (CIII) · Tx mantenimiento: Itraconazol 200mg VO c/8h por 3 días y después c/12 h.(AII) | · Los niveles séricos de itraconazol deben ser monitorizados para asegurar la adecuada absorción. (AIII) |
| Enfermedad diseminada por MAC (Complejo Mycobacterium avium) | Por lo menos 2 fármacos como tratamiento inicial: Claritromicina 500mg VO c/12 h. (AI) + Etambutol 15 mg/kg VO c/24 h. (AI) Niñas/os: · Claritromicina 7.5 a 15 mg/kg/dosis c/12 h (máx. 500 mg/dosis) · Etambutol 15 a 25 mg/kg/dosis una vez al día (máx. 2.5 g/día). (AI) · Considerar adicionar una 3ao4a droga si el paciente tiene inmunosupresión severa (CD4 <50células/mm3) alta carga de micobacterias (>2 UFC ml o sangre) o en ausencia de TAR efectivo. (CIII) · Amikacina 10 a 15mg/kg c/24 h IV · Estreptomicina 1 gramo c/24 h IV o IM · Ciprofloxacina 500 a 750mg c/12 h VO · Levofloxacina 500mg c/24 h VO · Moxifloxacino 400mg c/24 h VO | · El tratamiento alternativo debe ser considerado cuando las interacciones farmacológicas o la intolerancia contraindican el uso de claritromicina · Azitromicina 500 a 600mg + etambutol 15mg/kg VO c/24 h. (AII) · Dosis pediátrica: 10 a 12 mg/kg/día una vez al día (máx. 500 mg/dosis). (AII) · De existir disponibilidad, rifabutina* 300mg VO c/24 h (la dosis debe ser ajustada basada en la interacción farmacológica) puede utilizarse también para reforzar el esquema recomendado convencionalmente. (CI) | · Se recomienda realizar pruebas de sensibilidad a claritromicina y Azitromicina. (BIII) · En personas vírgenes a TAR se inicia 2 semanas después de iniciado el Tx para MAC, para disminuir la cantidad de tabletas, interacciones y la posibilidad de SIRI. (CIII) · Los AINE pueden ser usados en pacientes con síntomas de SIRI moderado a grave. (CIII) · Si los síntomas de SIRI persisten utilizar un curso corto de esteroides sistémicos durante 4 a 8 semanas, el equivalente 20 a 40mg de prednisona. (CIII) |
| Meningitis criptococócica | · Anfotericina B (deoxicolato o liposomal) a dosis establecidas + Fluconazol 400mg VO c/24 h durante 2 semanas o hasta tener resultado de cultivo negativo para LCR. (BII) · Anfotericina B 0.7mg/kg c/24 h IV durante 2 semanas o hasta tener resultado de cultivo negativo para LCR. (BII) · Continuar tratamiento con fluconazol 200 a 400 mg VO c/12 h durante 2 meses y valorar suspensión o profilaxis secundaria. En niños/as: · Anfotericina B deoxicolato 1 a 1.5 mg/kg/dosis sola o en combinación con fluconazol 12mg/kg/día el día 1 y luego 10 a 12 mg/kg/día por 2 semanas. · Consolidación con Itraconazol 5 a 10mg/kg/día por al menos 8 semanas. (BI) · Consolidación 10-12mg/kg/d por 8 semanas (AI) · Consolidación con itraconazol 5 a 10mg/kg/día por al menos 8 semanas. (BI) | · Anfotericina B deoxicolato 0.7mg/kg IV c/24 h + Fluocitosina 100mg/kg VO c/24 h dividida en 4 dosis durante 2 semanas. (AI) · Anfotericina B (lipídica) 4 a 6mg/kg IV c/24 h (pacientes con disfunción renal) + Fluocitosina 100mg/kg c/24 h en 4 dosis por lo menos 2 semanas. (AIII) · Fluconazol 400 a 800mg c/24 h VO o IV + fluocitocina 100mg/kg c/24 h VO dividido en 4 dosis por 4 a 6 semanas (CII) para personas que no toleran o no responden a la anfotericina B. | · La adición de Fluocitosina* a la anfotericina B ha sido asociada con esterilización más rápida de LCR y disminución del riesgo de recaída subsecuente. · Monitorear los niveles séricos de Fluocitosina*, la dosis pico después de 2 h no debe exceder 75ug/ml. · La dosis debe ajustarse en falla renal. · La presión de apertura deberá ser siempre medida cuando se realiza PL. (AII) · Repetidas PL o derivación del LCR son esenciales para el manejo efectivo del incremento de presión intracraneal. (BIII) |
| Sífilis Treponema pallidum | Sífilis primaria, secundaria o latente temprana: · Penicilina benzatínica 2.4 millones UI IM 1 dosis. (AII) En niñas/os la dosis es de 50,000 UI/kg/día (máx. 2.4 millones). (AII) Sífilis latente tardía (>1 año o duración desconocida, en quienes la examinación de LCR ha excluido neurosífilis) · Penicilina Benzatínica 2.4 millones UI IM semanalmente 3 dosis. (AIII) En niños la dosis es de 50,000 UI/kg/día (máx. 2.4 millones). (AIII) Neurosífilis (incluyendo sífilis ótica y ocular) · Penicilina G cristalina (acuosa) 18 a 24 millones UI c/24 h administrada 3 a 4 millones UI c/4h IV o en infusión continua por 10 a 14 días (AII) + Penicilina benzatínica 2.4 millones UI IM semanalmente por 3 dosis después de terminar el tratamiento IV. (CIII) · En niños: penicilina sódica cristalina 200,000 a 300,000 UI/kg/día IV administrando 50 mil UI/kg c/4 a 6 h (máx. 18-24 millones de unidades por día) por 10-14 días. (AII) En niños con sífilis congénita: · Penicilina G sódica cristalina 100,000-150,000 UI/k/día, IV administrando 50 000 UI/k/dosis c/12hrs por 7 días y continuar cada 8hrs por 10 días · Si el diagnóstico se hace después del mes de vida: penicilina sódica cristalina 200,000-300,000 UI/kg día, administrando 50,000 UI/kg/dosis c/ 4 a 6 h por 10 días. (AIII) | Sífilis primaria, secundaria o latente temprana: · Alérgicos a penicilina - Doxiciclina 100mg c/12 h VO por 14 días. (BIII) - Ceftriaxona 1 gr c/24 h IM o IV por 8 a 10 días. (BIII) - Azitromicina 2g DU VO. (CII) Sífilis latente (sin involucro de SNC) · Alérgicos a penicilina: Doxiciclina 100mg c/12 h VO por 28 días. (BIII) Neurosífilis · Penicilina procaínica 2.4 millones UI c/24 h IM + probenecid 500 mg c/6 h VO por 10 a 14 días (BII) + penicilina benzatínica 2.4 millones UI IM semanalmente 3 dosis después de terminar el esquema anterior. (CIII) · Alérgicos a penicilina: Desensibilización a penicilina es lo indicado. Si no es posible: Ceftriaxona 2g c/24 h IV o IM por 10 a 14 días. (CIII) | · La eficacia del tratamiento alternativo a la penicilina no ha sido evaluada en personas con VIH. Deberá ser usado solamente con monitoreo clínico y serológico estrecho. (BIII) · La combinación de penicilina procaínica y probenecid no es recomendada en personas con antecedente de alergia a las sulfas. (DIII) · La reacción de Jarisch-Herxheimer es una reacción aguda febril con cefalea y mialgias, que ocurre dentro de las primeras 24 h del inicio de tratamiento de sífilis. |
| *Medicamentos no disponibles para su uso regular en México. Desensibilización a penicilina por vía oral: Este procedimiento requiere la hospitalización del individuo en una unidad de cuidados intensivos con y estricta supervisión médica, previo consentimiento firmado por la persona o la familia. Los bloqueadores b adrenérgicos deberán ser descontinuados, incluyendo las gotas oftálmicas. La dosis inicial es de 1x10.000 de la dosis recomendada. La dosis es entonces duplicada cada 15 minutos, hasta que la dosis terapéutica sea alcanzada, generalmente esto se consigue en 4-5 horas. Si se producen síntomas, la administración es disminuida o detenida y la persona debe ser tratada adecuadamente. La reacción leve más frecuente con el protocolo de desensibilización es el rash pruriginoso (hasta 30% de los casos). Éste puede presentarse durante y después del procedimiento. Usualmente desaparece con el progreso de la desensibilización, pero puede requerir tratamiento sintomático. (CII) Desensibilización a sulfas: Este protocolo se puede realizar en uno de dos esquemas propuestos, para 3 o 9 días (ofrecen un potencial de respuesta de 77 a 84%, respectivamente). (BIII) Esquema de 3 días. Se indica TMP/SXZ en suspensión, y administran dosis crecientes de acuerdo con la secuencia indicada más adelante: (BIII) Día 1. TMP/SMX. 1) horario 9 a.m. dosis 0.8/4 mg; 2) 11 a.m., 1.6/8 mg; 3) 1 p.m., 4/20 mg; y 4) 5 p.m., 8/40 mg; Día 2. TMP/SMX. 1) Horario 9 a.m. dosis 16/80 mg; 2) 3 p.m., 32/160 mg; y 3) 9 p.m., 40/200 mg; Día 3. TMP/SMX. 1) horario matutino, dosis 80/400 mg. Para todos los tipos de sulfas, la desensibilización está contraindicada en reacciones severas como Síndrome de Stevens Johnson, agranulocitosis o alveolitis fibrosante. (EIII) No se recomienda la premedicación con corticosteroides o antihistamínicos para los procedimientos de desensibilización la premedicación, porque estas drogas no han demostrado efectividad para suprimir la respuesta anafiláctica y podrían enmascarar manifestaciones alérgicas leves. (DIII) |
Tabla III-B. Profilaxis primaria de infecciones oportunistas activas
| Enfermedad | Indicaciones | Recomendada | Alternativas | Comentarios |
| Neumonía por Pneumocystis jirovecii (PCP) | Iniciar profilaxis: · CD4 <200 células/mm3(AI) · o CD4 <14% (BII) · o con Candidiasis oral(AII) · o enfermedad definitoria de sida(BII) · CD4 =200 pero =250 células/mm3 si la monitorización de CD4 entre 1 a 3 meses no es posible. (BII) En niñas/os · >6 sem a <12 meses, iniciar a todos independientemente de su condición inmunológica. · 1 a 6 años con CD4 <500 o <15% 6-12 años con CD4 <200 células o <15%.(AII) | · TMP/ SMX 160/800mg c/24 h VO (AI) u 80/400mg c/24 h.(AI) Niñas/os · TMP/SMX: 2.5 a 5 mg/kg/dosis c/12 h3 días por semana en días consecutivos o en días alternos.(AI) | · TMP/SXZ 160/800 mg 3 veces por semana VO (BI) o · Dapsona 100 mg VO c/24 h o 50mg VO c/12 h (BI) o · Dapsona 50mg VO /24 h + pirimetamina 50mg VO c/sem +leucovorín 25mg VO c/sem (BII) o · Pentamidina* aerosolizada 300mg nebulizada cada mes (BI) o · Atovacuona* 1,500mg VO c/24 h(BI) o · Atovacuona* 1,500mg VO + pirimetamina 25mg + leucovorín 10mg VO c/24 h.(CIII) · En niños la dosis de dapsona en mayores de 1 mes: 2mg/kg/día (máx. 100 mg día). | Suspender profilaxis con: · CD4 >200células/mm3 por =3meses en respuesta a TAR confirmada en cuando menos dos determinaciones consecutivas. (AI) · En niñas/os que tengan >6 meses en TAR y 1 a 6 años con CD4 15% o CD4 >500células/mm3. Niños mayores de 6 años, CD4 >15% o CD4 >200 células/mm3. · Estas cifras de CD4 deben de mantenerse al menos 3 meses consecutivos. · En niñas/os menores de un año, no suspender. (BII) · Reiniciar profilaxis si CD4 <200células/mm3. (AIII) · En niñas/os reiniciar si en las evaluaciones de c/3 meses hay indicación de acuerdo con la cifra o porcentaje de CD4.(BIII) |
| Toxoplasmosis | Iniciar profilaxis: · Personas con IgG vs Toxoplasma positivo con CD4 <100 células/mm3. (AII) · Persona seronegativa recibiendo profilaxis para PCP no activa vs. toxoplasma se deberá realizar de nuevo serología si CD4 =100 células/mm3. (CIII) · La profilaxis deberá ser iniciada si la seroconversión ocurre. (AII) Niñas/os: IgG e inmunosupresión grave: · < de 6 años, CD4 <15% > 6 años CD4 <100 células/mm3.(AIII) | · TMP/SXZ 160/800 mg c/24 h VO. (AII) Niñas/os: · TMP/SMX 150 mg/m2SC/día VO.(AII) | · TMP/SXZ 160/800 mg 3 veces por semana VO (BIII) o · TMP/SXZ 80/400 mg c/24 h VO (BIII) o · Dapsona 50 mg VO c/24 h + pirimetamina 50mg VO c/sem + leucovorín* 25mg VO c/sem (BI) · Dapsona 200mg + pirimetamina 75mg + leucovorín 25mg VO c/sem. (BI) · Atovacuona* 1,500mg + pirimetamina 25mg + leucovorín* 10mg VO c/24 h.(CIII) Niñas/os: · Dapsona >1 mes: 2mg/kg/día (máx. 100 mg día). (BI) más pirimetamina 1mg/kg (máx. 25mg) c/24 h más leucovorín 5mg VO c/3 días | Suspender el tratamiento con: · CD4 >200 células/mm3durante >3 meses en respuesta a TAR confirmada en cuando menos dos determinaciones consecutivas. (AI) Niñas/os: · Más de 6 meses en TAR y 1 a 6 años con CD4 >15% por 3 meses consecutivos. · En mayores de 6 años, CD4 >200 por 3 meses consecutivos. (BIII) · Reiniciar profilaxis siCD4 =100 células/mm3.(AIII) |
| Tuberculosis | · Pruebas diagnósticas de TB latente PPD >5 mm de induración, sin evidencia de TB activa, no antecedente de tx previo para TB activa o latente. (AI) · Prueba negativa, pero contacto cercano con una persona con TB pulmonar y sin evidencia de TB activa. (AII) | · Isoniazida 300mg VO c/24 h(AII) o · Isoniazida 900mg VO 2 veces por semana por 9 meses (BIII) · Ambos con piridoxina 50mg VO c/24 h. (BIII) Niñas/os · Isoniazida 10-15 mg/kg/dosis (máx. 300 mg/día) c/24 h por 9 meses (AII) +Piridoxina 1-2 mg/kg/dosis (máx. 25 a 50 mg). (BIII) · En pacientes expuestos a TB multidrogorresistente la selección del tratamiento se debe consultar con un experto.(AII) | · Rifampicina 600mg VO c/24 h por 4 meses (BIII) o · Rifabutina* 300 mg VO c/24 h ajustada con base en TAR concomitante por 4 meses. (BIII) Niñas/os: · Rifampicina 10 a 20 mg/kg/dosis (máx. 600 mg) por 4 a 6 meses.(BII) | · Alta incidencia de interacciones farmacológicas y hepatotoxicidad con esquema de rifampicina y pirazinamida, por lo cual no se recomienda1. · La dosificación de isoniazida de 900 mg VO dos veces por semana no debe considerarse en individuos con CD4 totales inferiores a 100 células/mm3. |
| Complejo Mycobacterium avium (MAC)enfermedad diseminada | · CD4 <50células/mm3 después de excluir infección activa por MAC.(AI) | · Azitromicina 1,200 mg VO (AI) · Claritromicina 500 mg c/12 h VO (AI) o · Azitromicina 600mg VO 2 veces por semana. (BIII) Niñas/os · Azitromicina 5 mg/kg dosis c/24 h (máx. 250 mg) o · Claritromicina 7.5 mg/kg/dosis c/12 h + etambutol 15 a 25 mg/kg/dosis c/24 h (AI) | · Rifabutina* 300mg VO c/24 h (BI) dosis ajustada con base a TAR concomitante, excluir TB activa antes de iniciar rifabutina. | Suspender profilaxis con: · CD4 >100 células/mm3por =3 meses en respuesta al TAR (AI) Reiniciar profilaxis si: · CD4 <50células/mm3(AIII) Niñas/os · Descontinuar cuando cumplan todo lo siguiente: - 6 meses de TAR y 12 meses de tratamiento con el régimen elegido asintomáticos y - De 2 a 6 años que tengan CD4 mayor a 200 por >6 meses consecutivos (AII) - Mayores de 6 años con CD4 >100 por >6 meses consecutivos. (AI) |
| Virus varicela- zoster (VVZ) | Prevención preexposición: · CD4 >200células/mm3, en personas no vacunadas o sin historia de infección previa por varicela o herpes zoster o Seronegativos a VVZ. (CIII) Postexposición · Contacto cercano con una persona con infección activa por varicela o herpes Zoster · Para personas susceptibles sin vacunación previa o seronegativas a VVZ.(AIII) | Prevención preexposición: · Vacunación (Varivax2 dosis (0.5ml) SC administradas c/3 meses. (CIII) · Si la vacunación produce enfermedad, el tratamiento con aciclovir está recomendado. (AIII) Postexposición: · Inmunoglobulina vs varicela zoster (VariZIG) 125 IU por 10kg (máximo 625 IU) IM · Administrarla dentro de las 96h después de la exposición a personas con infección activa.(AIII) | · Contactos cercanos de pacientes con VIH deberán ser vacunados para prevenir transmisión potencial de VVZ. (BIII) Tratamiento alternativo postexposición: · Vacuna de varicela (Varivax) 0.5ml SC por 2 dosis, c/3 meses si CD4 >200células/mm3(CIII) o · Aciclovir preventivo 800mg VO 5 veces al día por 5 días (CIII) Niñas/os: Aciclovir 20 mg/kg/dosis VO c/6h por 7 días iniciando 7 a 10 días postexposición.(CIII) | · No se recomienda la prueba serológica de rutina para VVZ en personas adultas con VIH. · Consultar capítulo de vacunación. |
| Malaria | Viajeros a zonas endémicas (AIII) | · Doxiciclina 100mg c/24 h VO iniciar 2 días antes de viajar, durante toda la estancia en la zona y 4 días después de abandonarla. Niñas/os: Doxiciclina, con <45 kg 2.2 mg/kg/dosis (AIII) c/24 h, 2 días antes del viaje, durante toda la estancia y hasta 4 semanas después. · Meloquina 250mg DU c/semana, iniciar 2 semanas previas a viajar, c/semana durante estancia y 4 semanas posterior a abandonarla. · Primaquina 300mg c/24 h VO durante 14 días posterior a abandonar una zona endémica. | · Cloroquina 500mg DU cada semana, iniciarla 2 semanas previas a viajar, c/semana durante la estancia en la zona y 4 semanas después de abandonarla (AIII) · Atovacuona/proguanil 100mg c/24 h VO iniciar 2 días antes de viajar a la zona endémica, tomarlo diariamente mientras se esté en la zona y 7 días posterior a abandonarla (aún no disponible en México). | |
| Profilaxis recomendadas en zonas endémicas | ||||
| Coccidioides immitis | · Prueba serológica positiva IgM o IgG y CD4 <250células/mm3. (CIII) Niñas/os · En general no se recomienda profilaxis.(BIII) | · Fluconazol 400 mg VO c/24 h(CIII) · Itraconazol 20mg VO c/12 h(CIII) | · Itraconazol 200 mg c/24 h (CIII) | · Baja California, Chihuahua, Coahuila, Sinaloa, Sonora y Nuevo León. · Arizona y California en EUA. · Suspender profilaxis si CD4 >200células/mm3>6meses (CIII) · Reiniciar profilaxis si: CD4<200células/mm3(CIII) · En niñas/os reiniciar con cuenta de CD4 <100células/mm3. |
| Infección por Histoplasma capsulatum | · Riesgo ocupacional y/o vivir en área hiperendémica (>10casos/100 pacientes/año) con CD4 <150células/mm3(CI) · No se recomienda el uso rutinario de profilaxis primaria.(BIII) | · Itraconazol 200 mg c/24 h VO (CI) | | · Se consideran endémicas áreas en donde existen cavernas o húmedas-tropicales (ej. Guerrero, Tabasco, Chiapas, Quintana Roo, Yucatán). · Suspender profilaxis con: CD4 >200células/mm3por más de 3 meses como respuesta a TAR. (CIII) · Reiniciar profilaxis en personas con alto riesgo de adquirir histoplasmosis. CD4 <200células/mm3(CIII) |
| Las profilaxis primarias para candida, citomegalovirus, criptococo o herpes no se recomiendan en la actualidad. *Medicamentos no disponibles para su uso regular en México. 1Para mayor información de tuberculosis, refiérase al capítulo de coinfección VIH/TB. | ||||
Tabla III-C. Profilaxis secundaria de infecciones oportunistas activas
| Recomendadas como estándar | ||||
| Enfermedad | Indicaciones | Medicamento | Alternativa | Comentarios |
| Pneumocystis jirovecii (PCP) | Antecedente de neumonía atípica o intersticial confirmada o con sospecha de P. jirovecii | · TMP/SMX 160/800 mg c/24 h(AII) · TMP/SMX 80/400 mg c/24 h(AI) · Niños: TMP/SMZ2.5 a 5 mg/kg/dosis c/12 h, 3 días consecutivos por semana (AI) | · TMP/SMX 160/800mg VO c/12 h(BI) · Dapsona 50mg VO c/12 h o 100 mg c/24 h VO (BII) · Dapsona 50mg VO c/24 h + pirimetamina 50mg VO por semana +leucovorín 25mg VO por semana (BI) · Dapsona 200mg VO + pirimetamina 75mg VO + leucovorín 25mg VO por semana (BI) o · Pentamidina* aerosolizado 300mg c/mes vía nebulizador Respirgard II (BI) · Atovacuona* 1,500mg VO c/24 h(BI) Atovacuona* 1,500mg + pirimetamina25mg + leucovorín 10mg VO c/24 h(CIII) Niños: >1 mes, dapsona 2 mg/kg/día o 4 mg/kg/semana (BII) | Suspender profilaxis: · CD4 >200células/mm3 por =3meses en respuesta a TAR(BII) · Si PCP es diagnosticada con CD4 >200células/mm3la profilaxis deberá ser continuada de por vida, o bien hasta que exista recuperación inmune sostenida en individuos con TAR y por lo menos 2 CV de VIH indetectables (CIII) Niñas/os · Los criterios para suspender son igual que en la profilaxis primaria (BII) Reiniciar profilaxis: · CD4 <200células/mm3(AIII) o · PCP recurrente con CD4 >200células/mm3(CIII) |
| Bartonella henselae | Angiomatosis bacilar, peliosis hepática, bacteriemia, osteomielitis | · Eritromicina 500mg VO c/6h(AII) o · Doxiciclina 100mg VO c/12 h(AII) · Indicada en pacientes con recaída o reinfección hasta que los CD4 >200 células/mm3(AIII) | | Suspender profilaxis: · Si cumple con todos los siguientes criterios. (CIII) - Recibir 3 a 4 meses de tratamiento - CD4 >200cel/uL por >6 meses - Disminución de los títulos serológicos de Ac vs Bartonella por lo menos 4 veces. (CIII) Reinicio de profilaxis: No recomendada |
| Toxoplasma gondii | Antecedente de masa ocupativa, enfermedad ocular, meningitis o encefalitis confirmada o con sospecha de Toxoplasma | · Pirimetamina 25 a 50 mg VO c/24 h + sulfadiazina 2,000 mg a 4,000 mg VO c/24 h (dividida en 2 o 4 dosis) + leucovorín* 10 a 25mg VO c/24 h.(AI) · Niñas/os, se usan las siguientes dosis: - Pirimetamina: 1 mg/kg/dosis cada 24 h (máx. 25 mg). - Sulfadiazina 42.5 a 60mg/kg/dosis. dos veces al día (máx. 2 a 4 gr por día. - Leucovorín es de 5 mg cada 3 días. (AI) | · Clindamicina 600mg VO c/8h + pirimetamina 25 a 50mg VO c/24 h + leucovorín 10 a 25mg VO c/24 h(BI) (se deberá dar tratamiento adicional para prevenir PCP (AII)o · Atovacuona* 75mg VO c/6 a 12 h + pirimetamina 25mg VO + leucovorín* 10mg VO c/24 h sulfadiazina* 2,000 a 4,000mg VO c/24 h(BII) · Dapsona 50 mg c/24 h + Pirimetamina 50 mg 1 vez/sem VO + Leucovorín* (ácido folínico) 25 mg 1 vez/sem VO (BII) Niñas/os: · Se recomienda clindamicina 7 a 10 mg/kg/dosis c/8h(BII) | Suspender profilaxis: · Éxito completo con terapia inicial, asintomático de signos de encefalitis y CD4 >200cel/uL por >6 meses en respuesta a TAR(BI) Niños · Suspender cuando cumplan todos los siguientes criterios: - 6 meses con TAR>asintomáticos - CD4 >15% en niños de 1 a 6 años o >200 células en niños mayores de 6 años por > 6 meses consecutivos (BI) Reiniciar profilaxis: · CD4 <200cel/uL (AIII) Niñas/os · Reiniciar con CD4 <15% en 1-6 años o · <200 células en mayores de 6 años (BII) |
| Complejo Mycobacterium avium (MAC) | Enfermedad diseminada por complejo Mycobacterium avium(MAC) | · Claritromicina 500mg VO c/12 h (AI) + Etambutol 15mg/kg VO c/24 h(AI) Niñas/os: · Claritromicina 7.5 mg/kg/dosis c/12 h + etambutol 15-25 mg/kg/dosis c/24 h(AI) Duración: toda la vida (AII)excepto en pacientes con recuperación inmune sostenida por TAR. (BII) | | Suspender profilaxis: · Si cumple con todos los siguientes criterios (BII): - Completar 12 meses de tratamiento sin signos ni síntomas de MAC - CD4 >100células/mm3por >6 meses en respuesta a TAR Niñas/os: · Si cumple con todos los siguientes criterios: - Más de 6 meses en TAR - Más de 12 meses en tratamiento para MAC - Sin signos ni síntomas de MAC - CD4 >200células/mm3 en niños de 2 a 6 años por 6 meses consecutivos - CD4 >100 células/mm3en mayores de 6 años por 6 meses consecutivos (BII) Reiniciar profilaxis: · CD4 <100células/mm3. (AIII) |
| Candida albicans | Candidiasis en mucosas (orofaríngea, esofágica, vulvovaginal) | · El tratamiento supresor no se recomienda usualmente, a menos de que el paciente presente recurrencias frecuentes o graves (DIII). Si se decide iniciar profilaxis: Candidiasis orofaríngea: · Fluconazol 100mg VO c/24 h BI. Niñas/os: 3 a 6 mg/kg/dosis c/24 h (BI) · Itraconazol solución oral 200mg VO c/24 h (CI). Niñas/os: 2.5 mg/kg/dosis c/12 h(CI) Candidiasis esofágica: · Fluconazol 100 a 200mg VO c/24 h (BI). Niñas/os: 3 a 6 mg/kg/dosis cada 24 h(BI) · Posaconazol 400mg VO c/12 h(BII) Candidiasis vulvovaginal: · Fluconazol 150mg VO c/semana. (CII) · Azoles tópicos diario.(CII) | | Suspender profilaxis: · CD4 >200células/mm3(CIII) Niñas/os: · Categoría inmunológica 1 a 2. (CIII) Reinicio de profilaxis: · No recomendado. · El uso crónico de azoles puede promover resistencia. |
| Cryptococcus neoformans | Meningitis criptocócica | · Fluconazol 200mg VO c/24 h(AI) de por vida o hasta que CD4 >200células/mm3 por >6 meses como resultado de TAR. (BII) Niñas/os · Fluconazol 6 mg/kg/dosis c/24 h(AI) | · Itraconazol 200mg VO c/24 h de por vida, a menos que haya reconstitución inmune como resultado de TAR, para pacientes intolerantes o quienes fallan a fluconazol (BI) Niñas/os · Itraconazol 5 mg/kg/dosis c/24 h(BI) | Suspender profilaxis: · Si cumple con todos los siguientes criterios (BIII) - Completar tratamiento inicial - Asintomático - CD4 >200células/mm3por >6 meses en respuesta a TAR - Cultivo de LCR y Antígeno de Criptococo negativo antes de suspender tratamiento (CIII) - En niñas/os: se suspende si son mayores de 6 años, asintomáticos por más de 12 meses y con CD4>100células/mm3 con carga indetectable por más de 3 meses. (CIII) Reiniciar profilaxis: · CD4 <200células/mm3(AIII) · Niñas/os: CD4 <100células/mm3(AIII) |
| Citomegalovirus | Enfermedad por citomegalovirus (retinitis, esofagitis, colitis, neumonitis, enfermedad neurológica) | Retinitis por CMV: · Valganciclovir 900mg VO c/24 h(AI) · Implante de Ganciclovir, puede ser remplazado cada 6 a 8 meses, se mantienen los CD4 <100 células/mm3 + valganciclovir 900mg VO c/24 h hasta la recuperación inmune (BIII) Niñas/os: · Ganciclovir 5mg/kg/dosis c/24 h y >45 kg, valganciclovir como se indica abajo(AI) Esofagitis o colitis por CMV: · La profilaxis secundaria usualmente no es necesaria, pero deberá ser considerada si presenta recaídas (BII) Neumonitis por CMV: · El papel de la profilaxis secundaria no ha sido establecido. (CIII) Enfermedades neurológicas por CMV: · Valganciclovir 900mg VO c/24 h + Foscarnet* IV deberá ser continuada de por vida a menos que la recuperación inmune sea evidente (BII) | Retinitis por CMV: · Ganciclovir 5mg/kg IV 5 a 7 veces por semana (AI) o · Foscarnet* 90-120mg/kg IV c/24 h(AI) · Cidofovir* 5mg/kg IV c/semana, hidratación previa con solución salina + probenecid 2g VO 3h antes de la dosis, seguido por 1g VO 2h después de la dosis y 1g VO 8h después de la dosis (total 4g) (AI) | Suspender profilaxis: · CD4 >100células/mm3 por 3-6 meses en respuesta al TAR (BII) · El tratamiento deberá ser descontinuado solamente después de consultar a un oftalmólogo, tomando en cuenta la magnitud y duración del incremento de los CD4, localización anatómica de las lesiones, visión del ojo contralateral, y el acceso a monitoreo oftalmológico frecuente. (BII) · Se recomienda seguimiento oftalmológico de rutina (cada 3 meses) para una temprana detección de recaída o uveítis por reconstitución inmune (AII) Reiniciar profilaxis: · CD4 < 100células/mm3(AIII) |
| Virus herpes simple (VHS) | Infección por herpes simple genital, mucocutánea, encefalitis | · La profilaxis secundaria o tratamiento supresor solamente está indicado en pacientes con recurrencias frecuentes o severas de herpes genital. · Valaciclovir 500mg VO c/12 h(AI) · Famciclovir 500mg VO c/12 h(AI) · Aciclovir 400mg VO c/12 h(AI) · En niños: Profilaxis secundaria posterior a enfermedad neonatal de piel, mucosas o SNC con aciclovir 300mg/m2SC c/8h por 6 meses. (AI) | | Suspender profilaxis: La profilaxis deberá ser continuada de por vida, o bien hasta que exista recuperación inmune sostenida en personas con tratamiento antirretroviral altamente activo y por lo menos 2 cargas virales de VIH indetectables (CIII) |
| Penicillium marneffei | Peniciliosis | · Itraconazol 200mg VO c/24 h(AI) | | Suspender profilaxis: · CD4 >100células/mm3por >6 meses en respuesta al TAR. (BII) Reiniciar profilaxis: · CD4 <100 células/mm3(AIII) · Si la peniciliosis recurre a pesar de CD4 >100 células/mm3(CIII) |
| Leishmania sp | Leishmaniasis visceral | · Indicada en pacientes con CD4 <200 células/mm3 · Anfotericina B liposomal 4mg/kg c/2 a 4 semanas (AII) | · Anfotericina B complejo lipídico 3-4mg/kg c/2 a 4 semanas (AII) · Estibogluconato sódico 20mg/kg IV o IM c/4 semanas (AII) | Suspender profilaxis: · Incremento sostenido de CD4 >350células/mm3 por >3 a 6 meses en respuesta al TAR (CIII) Reiniciar profilaxis: No recomendada |
| Isospora belli | Infección por Isospora belli | · Indicada en personas con CD4 <200células/mm3 · TMP/SMX 160/800mg VO 3 veces por semana (AI) Niñas/os: · TMP/SMX 2.5 mg/kg/dosis c/12 h 3 veces por semana(AII) | · TMP/SMX 160/800mg VO c/24 h(BIII) · TMP/SMX 320/1600mg VO 3 veces por semana (BIII) · Pirimetamina 25mg VO c/24 h · Leucovorín* 5-10mg VO c/24 h(BIII) · Ciprofloxacina 500mg VO 3 veces por semana (CI) Niñas/os: · Pirimetamina 1mg/kg/dosis c/24 h o · Ciprofloxacino 10-20 mg/kg/día c/12 h 3 veces por semana (CI) | Suspender profilaxis: · Incremento sostenido de CD4 >200 células/mm3por >6 meses en respuesta a ARV sin evidencia de infección por I. belli(BIII) · Niñas/os: suspender cuando haya recuperación inmunológica sostenida por más de 6 meses(AII) Reiniciar profilaxis: No recomendada |
| Microsporidium sp, Enterocytozoon bieneusi y Vittaforma corneae | Microsporidio-sis (enfermedad diseminada, intestinal, ocular) | Enfermedad diseminada o intestinal: · Albendazol 400mg VO c/12 h (AII) · Niñas/os: Albendazol 7.5 mg/kg/día c/12 h (AII) Microsporidiosis ocular: · Fumagilina tópica 3mg/ml en solución oftálmica 2 gotas en el ojo c/6h (BII) más albendazol 7.5 mg/kg/d c/12 h (BIII) | | Suspender profilaxis: · El tratamiento en microsporidiosis ocular debe ser continuado indefinidamente para prevenir recurrencias o recaídas. (BIII) · Se suspende si no hay síntomas ni signos de microsporidiosis ocular. · CD4 >200células/mm3 por >6meses después de iniciar TAR. (BIII) · Niñas/os: suspender cuando haya recuperación inmunológica sostenida sin síntomas más de 6 meses. (BIII) Reiniciar profilaxis: No recomendado. |
| Salmonella spp | Bacteriemia recurrente sintomática | · Ciprofloxacina 500 mg VO c/12 h (CIII) | | · No existe una recomendación específica de profilaxis continua ni de un marcador para suspenderla |
| * Medicamentos no disponibles para uso regular en México | ||||
Anexo IV. Vacunación en las personas que viven con VIH
La inmunización es una de las medidas más efectivas para prevenir algunas infecciones que pueden acarrear complicaciones graves para las personas inmunodeprimidas a causa de la infección por VIH. Sin embargo, estudios recientes han demostrado que los niveles de anticuerpos protectores contra enfermedades infecciosas prevenibles por vacunación en personas que viven con VIH son bajos, lo que debe motivar al personal médico clínico a ser más acucioso para identificar y aprovechar oportunidades de vacunación en estos casos. Debido a esto, es especialmente importante procurar esquemas de vacunación completos y adecuados al grado de inmunosupresión en las personas que viven con VIH.
No existe ninguna vacuna 100% efectiva; esto es cierto incluso en personas completamente sanas e inmunocompetentes. Mientras mayor sea la inmunosupresión del paciente, el potencial de una vacuna para conferir protección será menor; no obstante, se recomienda aplicar vacunas en la mayoría de los casos y a pesar de dicho fenómeno en esta población. Tomando en cuenta que las personas que viven con VIH tienen una enfermedad crónica y que el tratamiento ARV permite una buena reconstitución inmunológica, en muchos casos puede optarse por iniciar el esquema de vacunación una vez que dicha reconstitución inmunológica se ha logrado (por lo general después del primer año de tratamiento). Desafortunadamente, aún en sujetos con adecuada reconstitución inmunológica, la respuesta serológica a la inmunización suele ser subóptima. Además, se ha reportado una elevada frecuencia de pérdida de la respuesta protectora.
En algunas situaciones, como en el contexto de epidemias, o cuando el individuo presenta características de riesgo elevado para adquirir determinada infección, puede optarse por iniciar la vacunación, aunque la inmunosupresión del paciente pueda interferir adversamente en la eficacia de esta intervención.
El uso de vacunas en las personas con VIH puede causar elevación de la CV en forma transitoria. El esquema de vacunación para las y los niños seguirá las recomendaciones internacionales y la disponibilidad de la vacuna, así como las especificaciones de esta población, de acuerdo con la siguiente propuesta.
Vacunación recomendada en niñas y niños con VIH
Se recomienda administrar las mismas vacunas que se aplican a niños y niñas que no tiene la infección por VIH, con las siguientes consideraciones:
· Vacuna BCG: Se recomienda administrar a RN con bajo riesgo de adquisición de VIH. En el escenario que exista un alto riesgo de adquisición del virus se recomienda diferir la vacunación hasta confirmar que el menor no está infectado. Contraindicada en las y los niños con VIH. (AII) Se recomienda considerar la aplicación de BCG en el niño o niña no vacunada, que está recibiendo TAR, clínicamente bien e inmunológicamente estable (CD4: menores de 5 años >25% y > 5 años > 200 cel); antes de vacunar hay que aplicar PPD o realizar IGRA y ser negativos.
· Vacuna rotavirus: la infección por VIH no es una contraindicación para la aplicación de las dos vacunas autorizadas vivas atenuadas, aunque no existen datos de la eficacia de las vacunas de rotavirus en niñas y niños que viven con VIH. Dependiendo del tipo de vacuna son 2 o 3 dosis. (BIII)
· Vacuna contra neumococo: la vacuna conjugada de neumococo en niñas y niños que viven con VIH es segura y eficaz, se sugiere de acuerdo con la edad, si no se aplicó el esquema de manera rutinaria.
- En niñas y niños de 0 a 6 años de edad con VIH se recomienda: Para aquellos niños con esquema incompleto de 24 meses a 71 meses aplicar 2 dosis de vacuna 13 valente separadas por lo menos 8 semanas. Los niños que recibieron previamente 3 dosis de vacunas conjugadas sólo requieren de 1 dosis de vacuna 13 valente.
- Niños de 2 o más años de edad deben recibir vacuna de polisacáridos después de su última dosis de vacuna conjugada (AII).
- En jóvenes de 7 a 18 años de edad con VIH se recomienda: Aplicar una dosis de vacuna 13 valente si no la recibió antes de los 6 años, la dosis puede ser aplicada al menos 8 semanas después de la última dosis de vacuna conjugada.
- Aplicar vacuna de polisacáridos por lo menos 8 semanas después de la última dosis de vacuna 13valente en niños mayores de 2 años. La revacunación puede realizarse 5 años después.
- En niños que anteriormente se les aplicó una o varias dosis de vacuna de polisacáridos deben recibir una dosis de vacuna 13 valente por lo menos 8 semanas después de la última dosis de vacuna polisacárida. Una segunda dosis de vacuna polisacárida está recomendada aplicar 5 años después. (AII)
· Vacuna triple viral (antisarampión, antiparotídea y antirrubeóla): se deberá aplicar si no hay evidencia de inmunosupresión grave. En niñas y niños con infección por VIH que fueron vacunados antes de iniciar TAR y no tienen inmunosupresión grave se recomienda recibir dos dosis, a menos que haya
evidencia de inmunidad. Los contactos intrafamiliares no inmunes deben ser vacunados. (AIII)
· Vacuna contra varicela: considerar su aplicación en niñas y niños que viven con VIH sin inmunosupresión grave, aplicar dos dosis con un intervalo mínimo de 3 meses, la primera dosis administrarla lo más pronto posible después del año de edad. Se recomienda vacunar a todos los contactos susceptibles de pacientes inmunocomprometidos. (AIII)
· Vacuna Sabin o polio oral: no está recomendada en personas con sida. (CIII)
· Vacuna de hepatitis A: recomendada en todos las y los niños que viven con VIH, de forma especial en aquellos que estén coinfectados con VHB/VHC, ya que tienen el riesgo de hepatitis fulminante durante la primoinfección con VHA. Aplicar de los 12 a 23 meses de edad, dos dosis separadas de 6 a 18 meses. (AII)
Tabla IV-A. Esquema de vacunación recomendado para personas entre 0 y 9 años
| Edadu Vacunaq | Enfermedad que previene | Al nacer | 2 meses | 4 meses | 6 meses | 7 meses | 12 meses | 18 meses | 2-3 años | 4-9 años |
| BCG | Tuberculosis | CONTRAINDICADA EN PACIENTES CON SIDA.DIFERIR EN NIÑAS Y NIÑOS CON NIVEL DE EXPOSICIÓN AL VIH DE ALTO RIESGO | ||||||||
| HEPATITIS B | Hepatitis B | 1ERA | 2DA | | 3ERA | | | | | |
| PENTAVALENTE ACELULAR DPaT+Vpi+Hib | Difteria, Tosferina, Tétanos, Poliomielitis e infecciones por H. influenzae tipo B | | 1ERA | 2DA | 3ERA | | | 4RTA | | |
| DPT | Difteria, Tosferina y Tétanos | | | | | | | | | Refuerz o 4 años |
| ROTAVIRUS | Diarrea por rotavirus | | 1ERA | 2DA | 3ERA* | | | | | |
| NEUMOCÓCICA CONJUGADA | Infección por neumococo | | 1ERA | 2DA | 3ERA | | 4RTA | | | |
| INFLUENZA | Influenza | | | | 1ERA | 2DA | ANUAL | |||
| SRP | Sarampión, Rubéola y Parotiditis | En casos con CD4>200 cel/mm3o >15% | 1ERA | | | Refuerz o 6 años | ||||
| SABIN | Poliomielitis | CONTRAINDICADA | ||||||||
| HEPATITIS A | Hepatitis A | | | | | | 1ERA | 2DA | | |
| VARICELA | Varicela | NO APLICAR EN INMUNOSUPRESIÓN GRAVE | 1ERA | 2DA a los 15 meses | | | ||||
*Dosis de Rotavirus de acuerdo a la vacuna disponible
Tabla IV-B. Esquema de vacunación recomendado para personas entre 10 y 19 años
| EdaduVacunaq | Enfermedad que previene | 10 años | 11 años | 12 años | 13 años | 14 a 16 años | 17 a 19 años |
| HEPATITIS B | Hepatitis B | | | 12 años (1 dosis re refuerzo y 3 dosis en no vacunados) | |||
| Td/Tdpa | Tétanos y Difteria | Un refuerzo cada 10 años | |||||
| SR | Sarampión y Rubeola | | | | A partir de los 13 años en casos con CD4>200 cel/mm3 o >15% | ||
| Otras vacunas | |||||||
| PAPILOMA HUMANO | Papiloma humano | | A partir de los 9 años, 3 dosis: 0 , 1, ó 2 y 6 meses | ||||
| INFLUENZA | Influenza | Anual | |||||
| NEUMOCÓCICA POLISACARIDA | Infección por neumococo | Adicionales (ver texto) | |||||
| VARICELA | Varicela | Adicionales en casos sin inmunosupresión grave | |||||
Adaptado de Advisory Committee on Immunization Practices (ACIP) recommended immunization schedules for adults and adolescents. CDC. septiembre 2017
También es importante reconocer que todas las vacunas pueden tener efectos adversos que fluctúan en intensidad, desde los leves y autolimitados, hasta los graves y potencialmente fatales. Afortunadamente, las vacunas aprobadas en la actualidad presentan un balance riesgo-beneficio muy favorable. En términos generales, se puede considerar que los efectos adversos de las diferentes vacunas en PVV son los mismos que en la población general. Las únicas excepciones potenciales a este hecho son las vacunas elaboradas con gérmenes vivos atenuados, las cuales se asocian al riesgo de presentar un fenómeno infeccioso secundario a la vacunación. Las vacunas aprobadas pueden clasificarse en 2 grupos principales:
· Vacunas especialmente recomendadas en PVV, debido a que esta población presenta un riesgo especialmente elevado de ciertas enfermedades o de presentaciones más graves de las mismas, ej. vacuna antineumocócica.
· Vacunas contraindicadas parcial o absolutamente, debido a un mayor riesgo de eventos adversos en personas inmunosuprimidas (aunque no exclusivamente en personas con VIH y sida), ej. vacuna contra herpes zoster y BCG.
El esquema de vacunación para las personas adultas con VIH es el propuesto en la tabla IV-C, incluso aunque se encuentre tomando TAR. La vacuna contra herpes zoster está contraindicada en PVV, independientemente de su nivel de CD4, debido a los mayores niveles de virus atenuado que contiene, comparada con la vacuna contra varicela.
La recomendación de la vacuna contra el VPH debe considerarse con base en características individuales, teniendo en cuenta, por un lado, que la protección máxima de esta vacuna se obtiene antes del inicio de la actividad sexual y, por otro lado, el mayor riesgo de desarrollo de cáncer en PVV con infección por VPH. Es importante considerar que la vacunación contra VPH no es una indicación para suspender el escrutinio periódico de carcinoma cervico-uterino.
Tabla IV-C. Vacunación recomendada en población adulta con infección por el VIH
| Vacuna | Esquema | Contraindicaciones | Comentarios |
| Influenza estacional | Vacuna inactivada de influenza 0.5ml IM anualmente. (AIII) | · Historia de reacción anafiláctica al huevo o a alguno de los componentes de la vacuna. · Enfermedad moderada a severa. · Precaución durante las 6 semanas posteriores a una vacunación contra influenza en personas con historia de Síndrome de Guillain-Barré (SGB). · La vacuna intranasal está contraindicada en las PVV y sus contactos directos. | A partir del otoño de 2010 la vacuna contra la influenza H1N1 está incluida en la vacuna estacional. Todas las personas que viven con VIH.(AIII) |
| Antineumocócica (polisacárida) | - Vacuna polivalente 23 0.5mlIM DU (BII) - Revacunación c/5 años (CIII) Una dosis IM c/5 años. Considere la vacuna conjugada 13-valente en lugar de la polisacárida PPV-23, por ser más inmunogénica. | · Reacción anafiláctica previa a alguno de los componentes de la vacuna. · Enfermedad moderada a severa. | Las personas con VIH se consideran en riesgo alto de enfermedad neumocócica fatal. CD4 >200células/mm3 y que no haya recibido vacuna antineumocóccica en los 5 años previos. (AII) - CD4 <200 células/mm3 la vacunación puede ofrecerse. (CIII) - Pacientes que recibieron vacuna antineumocóccica cuando tenían CD4 <200 células/mm3 y los han aumentado a >200 células/mm3 en respuesta a TAR.(CIII) |
| Triple Viral (antisarampión, antiparotídea, antirrubeóla) | Una dosis SC (CIII). | · Reacción anafiláctica previa a alguno de los componentes de la vacuna. · Embarazo o posibilidad del mismo en las 4 semanas posteriores a la vacunación. · Adultos con CD4<200 células/mm3. | CONTRAINDICADA si CD4<200 células/mm3 (14%) o sida: En personas con CD4>200 células/mm3 puede aplicarse con seguridad. |
| Toxoide tetánico / diftérico (Td) | Una dosis cada 10 años (AII) | Reacción anafiláctica previa a alguno de los componentes de la vacuna. Historia de encefalopatía dentro de los 7 días siguientes a la aplicación de DPT. Historia de SGB en las 6 semanas siguientes a inmunización con Td/DPT. | Puede darse un primer refuerzo con DPT y continuar Td cada 10 años. |
| Hepatitis A | Dos dosis IM (basal y 6 meses después de la primera dosis) (AII). Refuerzo a los 5 años. | · Reacción anafiláctica previa a alguno de los componentes de la vacuna. · Enfermedad moderada a severa. | Primordial en HSH, coinfección con VHB o VHC, usuarios de drogas intravenosas y en hepatopatía crónica. Tres dosis si el conteo celular de CD4 es menor de 200 células/mm3 |
| Hepatitis B | Tres dosis IM (basal, al mes y 6to. mes) - Todas las personas sin evidencia de exposición previa (seronegativas) a VHB deben ser vacunadas, incluyendo personas con CD4 200células/mm3(AII) - Vacuna de HVB IM (Engerix-B) 20ug/ml o HB recombinante 10ug/ml en el mes 0,1 y 6. (AII) - Los anticuerpos vs. Ags HVB deben ser positivos 1mes después de completar las 3 dosis.(BIII) | · Reacción anafiláctica previa a alguno de los componentes de la vacuna. · Enfermedad moderada a severa. | Descartar primero infección crónica por VHB. Evaluar seroconversión un mes después de completar el esquema, midiendo niveles de anticuerpos contra antígeno de superficie del VHB; considerar revacunación con un nuevo esquema completo en no respondedores. - Personal experto recomienda vacunar con dosis de 40 ug (o por vía intradérmica) en no respondedores, particularmente con cuenta baja de CD4. (CIII) - Personas con Anti core HVB: considerar escrutinio con carga viral DNA de HVB antes de la vacunación para excluir infección crónica oculta por HVB. - No respondedores a la vacuna: Definida como anticuerpos vs. Ags HVB <10 IU/ml 1 mes posterior a la vacunación. |
| Virus de papiloma humano | Vacuna recombinante tetravalente contra VPH 6/11/16/18 Tres dosis de 0.5 ml. Con un esquema de intervalos de 0-1/2-6 meses entre dosis (AII) - CD4 >200células/mm3(CIII) | | - Hombres y mujeres de 9 a 11 años. (CIII) La eficacia de la vacuna es cuestionable si ya hay infección por VPH. |
| Rabia | Preexposición: 3 dosis IM. Refuerzo al año, y 3-5 años. Postexposición: 6 dosis IM, en los días 0, 3, 7, 14, 30 y 90. La primera dosis acompañada de globulina inmune antirrábica o suero antirrábico.(CIII) | · Reacción anafiláctica previa a alguno de los componentes de la vacuna. · Evitar en mujeres embarazadas o durante la lactancia a menos de que exista riesgo absoluto de enfermedad. | La vacunación preexposición se recomienda en personas de alto riesgo laboral (ej. veterinarias/os) o que viajan a zonas endémicas. En caso de exposición y asociada a Ig. |
| Haemophilus influenzae (Hib) | Una dosis (no requiere refuerzos) (BII) | | |
| Meningococo | Use la vacuna conjugada (2 dosis) y continúe con la polisacárida. (BII) | | Dos dosis si se encuentra asplenia o disfunción esplácnica. |
| Tifoidea oral Polio oral | | | CONTRAINDICADAS, pues hay vacunas alternativas con agente inactivo. |
Anexo V. Coinfección con Hepatitis B y C
Coinfección VIH/VHC
Asociación VIH y Hepatitis C
La enfermedad hepática es una de las principales causas de muerte en las PVVS, la infección crónica por VHC es una de las principales cusas de cirrosis hepática. El VIH y el VHC, comparten vías de transmisión lo que se asocia con una gran carga de coinfección. Se han reportado prevalencias altas de infección por VHC en las PVVS, en países como Estados Unidos y de la Unión Europea, el 25% de las personas que tienen infección por VIH, están infectadas con el VHC. Las tasas de co-infección VIH/VHC se incrementa aún más en personas usuarias de drogas IV, hasta en un 70%.
Debido a la alta prevalencia de co-infección y al aumento en la incidencia de infección aguda por VHC entre los HSH con VIH en Europa y EU, en la actualidad está indicado realizar pruebas para detectar infección por VHC a todas las personas infectadas por VIH al momento del diagnóstico y después anualmente.
Tabla V-A. Factores de riesgo para infección por VHC (personas en las que se recomienda realizar
pruebas para descartar infección por VHC)
pruebas para descartar infección por VHC)
| Riesgo alto (prevalencias 25 70%) | - Antecedente o uso actual de drogas ilícitas IV. - Las personas que viven con VIH. - Factores de riesgo para la transmisión de la hepatitis C entre HSH VIH-positivos: ž Prácticas sexuales traumáticas con alta probabilidad de contacto sangre-sangre, sexo anal sin protección y fisting. ž Múltiples parejas sexuales. ž Presencia de otras ITS. - Las personas con hemofilia que recibieron concentrados de factor de coagulación antes de 1987. |
| Riesgo intermedio | - Personas que recibieron transfusiones o trasplantes de órganos antes de 1995. - Hijas e hijos de madres infectadas con VHC. - Personas con enzimas hepáticas elevadas. |
| Riesgo bajo | - Niñas y niños nacidos de madres infectadas con VHC. - Accidentes laborales con objetos punzocortantes. - Exposición accidental de mucosa con sangre de personas con VHC positivos en trabajadores sexuales. - Parejas sexuales actuales de las personas infectadas con el VHC. |
En México, un estudio sobre seroprevalencia de anticuerpos para hepatitis C en personas que viven con VIH, estimó que existen 3,748 personas seropositivas dentro de la Secretaría de Salud, arrojando una estimación de entre 4.0 y 4.6% de infección crónica de hepatitis C. Las prevalencias más altas se encontraron en Sonora y Baja California, sin embargo, la mayor cantidad de casos estimados se observó en la Ciudad de México con 564 casos (14.8% del total nacional), Estado de México con 345 (9.1%), Veracruz con 301 (7.1%), Jalisco con 279 (7.3%) y Baja California con 211 (5.6%), que en conjunto representaron el 45% del total de las personas con coinfección.
Algoritmo V-A. Diagnóstico de infección por VHC en personas con VIH
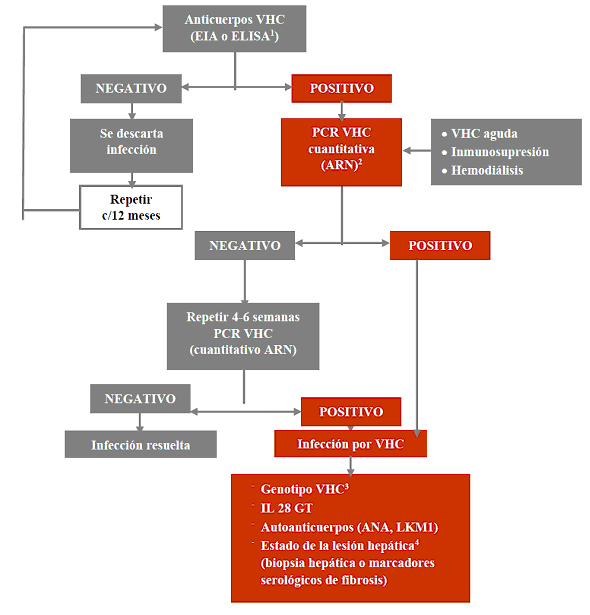
| 1 Los antiHCV pueden ser detectados en el suero o plasma mediante inmunoensayos. La especificidad de las EIA actuales es mayor a 99%. Los resultados falso negativos pueden ocurrir en el contexto de inmunosupresión severa, los receptores de trasplante de órganos o en pacientes en hemodiálisis. Un resultado positivo no descarta infección activa. 2 La reacción en cadena de la polimerasa (PCR) tienen en la actualidad una especificad de entre 98 y 99%. Es importante utilizar la misma prueba para el diagnóstico y seguimiento del tratamiento. No existe formula estándar de factor de conversión de la cantidad de RNA-VHC expresada en copias/ml, a la cantidad expresada en UI/ml (1 a 5 copias de RNA-VHC por UI/ml). 3 El genotipo es útil para predecir la posibilidad de respuesta y determinar la duración óptima de la terapia. El virus C se puede clasificar en al menos 6 genotipos (genotipos 1 a 6) El genotipo 1 (subtipos 1a y 1b) es el más común en América del Norte. 4 Razones para realizar una biopsia hepática: A) Información sobre el estado actual de la lesión hepática. B) Útil en la decisión de iniciar la terapia. C) Puede evaluar fibrosis avanzada o cirrosis que requiere vigilancia para el carcinoma hepatocelular. Existen varios métodos de marcadores serológicos de fibrosis como FibroScan o el Índice FIB4, el cual se calcula con la siguiente fórmula: Edad x AST/plaquetas x ALT (1/2) |
Tabla V-B. Interpretación de la pruebas contra VHC
| Anti-VHC | ARN VHC | Interpretación |
| + | + | VHC aguda o crónica |
| + | - | Resolución VHC |
| - | + | VHC aguda temprana (periodo de viremia de bajo nivel) VHC crónica en persona inmunosuprimida Falso positivo |
| - | - | Ausencia de infección por VHC |
Pacientes con diagnóstico de infección por el VHC, requieren de una evaluación clínica adicional. El objetivo de la evaluación pretratamiento permite descartar otras causas de enfermedad hepática y comorbilidades que pueden influir en el tratamiento, al estadio de la enfermedad, e identificar manifestaciones extrahepáticas si están presentes. Valoración que permite tomar la decisión sobre cuando iniciar el tratamiento y el esquema adecuado.
Historia Clínica
La evaluación clínica de los pacientes con VHC comienza con una historia completa. La historia debe incluir la búsqueda de:
1. Signos y síntomas de infección por VHC crónica, los cuales son muy inespecíficos.
2. Complicaciones relacionadas con hipertensión portal o datos de descompensación (sangrado gastrointestinal, ascitis, encefalopatía hepática e ictericia).
3. Manifestaciones extra-hepáticas pueden detectarse hasta en un 70% de los pacientes, mismas que son reversibles con el tratamiento.
4. Factores que pueden acelerar la progresión de la enfermedad hepática, como antecedentes de consumo de alcohol, la co-infección de otros virus hepatotrópos o diabetes.
5. Comorbilidades que pueden influir en el tratamiento, como enfermedad cardiovascular, por el riesgo de descompensación por efectos adversos a tratamientos. Se deben descartar enfermedades psiquiátricas debido a que tienen impacto negativo en el cumplimiento del tratamiento.
6. Conocer la exposición previa a tratamiento antiviral contra VHC y su respuesta es un aspecto fundamental para la elección del esquema de tratamiento.
Estudios de laboratorio
· En todos los pacientes se deben realizar:
- Conteo sanguíneo completo y diferencial
- Pruebas para evaluar la función renal: creatinina y cálculo del filtrado glomerular
- Pruebas para descartar otras coinfecciones por VHB
- Prueba de embarazo (para las mujeres) y ofertar plan de anticonceptivos en los pacientes de edad fértil
- Realizar marcadores de autoinmunidad para descartar patologías adyacentes como hepatitis autoinmunes, las cuales son más frecuentes en estos pacientes (cuando hay sospecha o datos que apoyen el diagnóstico)
- Pruebas de función tiroidea (si el tratamiento incluye INF o si existe sospecha de enfermedad tiroidea asociada a VHC) y glucosa en ayuno. Así como un panel metabólico completo para evaluar elevación de transaminasas y otros marcadores de la función sintética (bilirrubina, tiempo de protrombina, y albúmina)
- Genotipo viral. La familia de los virus HCV es extremadamente heterogénea, y al menos seis genotipos y numerosos subtipos han sido identificados. La elección del tratamiento, la dosificación y duración dependen del genotipo vira por lo que debe de realizarse en todo paciente con infección crónica por VHC.
Evaluación del grado de lesión hepática
La fibrosis es el factor más impactante en el proceso de evaluación. El grado de fibrosis define la urgencia para el inicio de la terapia y tiene implicaciones pronosticas en la eficacia del tratamiento, la duración y el riesgo de morbilidad y mortalidad
Para la evaluación del grado de lesión hepática existen diversos métodos que pueden dividirse en métodos invasivos y no invasivos.
Métodos invasivos
La biopsia hepática es el método tradicional para el diagnóstico de fibrosis hepática, ha sido históricamente el estándar de oro para la evaluación del grado de fibrosis y por lo tanto predecir el pronóstico de la enfermedad. Sin embargo, no es un estándar de oro fiable. Su utilidad es ampliamente debatida, especialmente por sus potenciales riesgos, variabilidad en la información suministrada y su uso ha disminuido de manera importante en la última década
La biopsia hepática es útil para tomar decisiones terapéuticas basadas en la estadificación de la enfermedad y para determinar el grado de actividad necroinflamatoria; evalúa el estadio en el cual se encuentra la enfermedad, siendo el punto de partida para determinar el inicio del tratamiento o diferirlo; más aún, teniendo en cuenta el costo, y los potenciales efectos adversos, permite valorar la probabilidad de respuesta a tratamiento y su posterior seguimiento. La biopsia también ayuda a descartar otras formas de enfermedad hepática o condiciones que alteren la historia natural de la enfermedad como por ejemplo esteatohepatitis, asociación con alcohol o hemocromatosis.
Para la evaluación de la biopsia hepática existen varios sistemas de gradación y estadificación, como Scheuer, Batts, Ludwig, Ishak y METAVIR; cualquiera de ellos puede ser utilizado; sin embargo, es claro que todos presentan variabilidad inter e intraobservador y errores de muestreo o tamaño de la muestra, siendo ideal contar con centros de referencia con experiencia en la patología hepática.
Métodos no invasivos
a) Marcadores de fibrosis hepática en el suero.
Las pruebas serológicas se pueden separar en numerosos marcadores indirectos y directos de fibrosis. Son los biomarcadores directos que reflejan el depósito o remoción de la llamada matriz extracelular en el hígado que incluyen entre muchos a glicoproteínas, colágenos y sus inhibidores. Y los llamados marcadores indirectos que indican alteración en la función hepática como los índices relacionados con aminotransferasas, bilirrubinas, protrombina y recuento de plaquetas. El resultado de su combinación se aplica en los estudios más ampliamente usados y validados como el APRI y el Fibrotest.
b) Medición de la rigidez hepática:
La elastografía es una técnica novedosa de imagen no invasiva que permite determinar la rigidez del hígado. La mayoría de los métodos de elastografía pueden diferenciar fibrosis mínima de fibrosis significativa, pero no pueden diferenciar de forma fiable entre las etapas de fibrosis. Fibroscan utiliza ultrasonido para determinar la rigidez del hígado basado en la propagación de las ondas.
Tabla V-C: Correlación entre los diferentes métodos para la evaluación de fibrosis hepática
| Estadio de fibrosis (escala Metavir) | Elastografía (fibroscan) | Fib4a | APRIb |
| F0-F1 | <6PKa | < 1.45 | < 1.45 |
| F2a | 6.1-9.4 PKa | | |
| F3 | >9.5-14.5 KPa | > 3.25 | > 3.25 |
| F4 | >14.6PKa | | |
a FIB4: se calcula con la siguiente fórmula: b APRI: se calcula con la siguiente fórmula:
|
|
Tabla V-D: Interpretación de resultados y correlación con Escala Metavir
| FibroTest1 | Escala Metavir | ActiTest2 | |
| Fibrosis | Necro inflamación | ||
| 0 - 0.21 | F0 | A0 | 0 0.17 |
| 0.22 0.27 | F0-F1 | A0-A1 | 0.18 0.29 |
| 0.28 0.31 | F1 | A1 | 0.30 0.36 |
| 0.32 0.48 | F1-F2 | A1A2 | 0.37 0.52 |
| 0.49 0.58 | F2 | A2 | 0.53 0.60 |
| 0.59 0.72 | F3 | A 2-A 3 | 0.61-0.62 |
| 0.73-0.74 | F3-F4 | A 3 | 0.63 1.00 |
| 0.75-1.00 | F4 | | |
1 Fibrotest: Edad, género, GGT, bilirrubinas, a2-macroglobulina, apolipoproteína A1, haptoglobina
2 ActiTest: Fibrotest + ALT. Refleja fibrosis hepática y actividad necroinflamatoria
| Fibrosis Mínima o ausente | Fibrosis moderada | Fibrosis severa | ||
| F0 Sin fibrosis | F1 Fibrosis Portal y periportal sin septos | F2 Fibrosis portal y periportal con mínimos septos | F3 Fibrosis portal y periportal con muchos septos | F4 Cirrosis |
| A0 Sin actividad | A1 Actividad mínima | A2 Actividad moderada | A3 Actividad severa | |
Tratamiento de la coinfección VHC/VIH
Tratamiento ARV
El objetivo del tratamiento es prevenir complicaciones y muerte por infección por el VHC. La progresión de la enfermedad hepática es más rápida en las personas VHC co-infectados por el VIH (dos veces más riesgo de cirrosis), particularmente en individuos con recuento de CD4 bajos (<350 células / mm3). El inicio del TAR y el control de la replicación viral del VIH, disminuye la progresión de la enfermedad hepática por VHC. Por lo que TAR se debe iniciar para la mayoría de los pacientes coinfectados, independientemente del recuento de CD4, para mantener control de la réplica viral y una adecuada situación inmunológica. El éxito del tratamiento de la hepatitis C también puede mejorar la tolerabilidad de la TAR, reduciendo el riesgo de hepatotoxicidad.
Sin embargo, en pacientes con VIH sin tratamiento previo y con recuento de CD4> 500 cel/mm3, se puede aplazar la TAR hasta finalizar el tratamiento del VHC. Para evitar la suma de toxicidades y las interacciones fármaco-fármaco de los ARV con los esquemas de tratamiento del VHC.
Para los pacientes con recuento de CD4 <200 cel/mm3, se puede preferir iniciar ARV y retrasar la terapia del VHC hasta que los recuentos de CD4 aumento como resultado del tratamiento del VIH.
La elección del esquema de ARV, debe guiarse por el régimen del tratamiento del VHC, considerando las posibles interacciones farmacológicas y las toxicidades superpuestas.
Tratamiento óptimo para VHC
Todos los pacientes con co-infección VIH/VHC son potenciales candidatos para la terapia antiviral contra el VHC. Los pacientes que más se benefician del tratamiento son los que tienen mayor riesgo de progresión enfermedad hepática. Es importante conocer el grado de compromiso hepático para determinar el tiempo adecuado de inicio del tratamiento o si puede diferirse; más aún, teniendo en cuenta el costo, y los potenciales efectos adversos, permite valorar la probabilidad de respuesta a tratamiento y su posterior seguimiento.
El tratamiento es prioritario en aquellos con fibrosis moderada (F2) o avanzada (F3-F4) o con manifestaciones extrahepáticas graves, y en las mujeres en edad fértil que se planteen un embarazo. En los pacientes con fibrosis F0-F1, puede ser aplazado el inicio de tratamiento.
Tabla V-E Interacciones entre los ARV y los antivirales de acción directa
| | ATV/r | Etalonato de Darunavir/c | Darunavir o Etalonato de Darunavir/r | LPV/r | EFV | ETV | NVP | RPV | MVC | RAL | DTG | EVG/c | ABC | FTC | 3TC | TDF | ZDV |
| DACLATASVIR | 110%(i) | | 40% | 15% | 32%(ii) | | | | | | | (i) | | | | 10%E10% | |
| ELBASVIR/GRAZOPREVIR | | E | E66% | E | 54%, 83% | | | | | | | | | | | | |
| OMBISTAVIR/PARITAPREVIR/r + DASABUSVIR | 94%(iii) | | D(iv) | | vi | E? | E? | E(vii) | E | E134% | E38% | | | | | | |
| OMBISTAVIR/PARITAPREVIR/r | (iii) | | (v) | | vi | E? | E? | E(vii) | E | E20% | | | | | | | |
| SOFOSBUVIR/LEDIPASVIR | 8/113%(viii) | E(viii) | 34/39%(viii) | (viii) | -/34%(viii) | | | (viii) | E? | D20% | | 36/78E (viii) | | | | E(viii) | |
| SOFOSBUVIR/VELPATASVIR | | | | | D | D | D | | | | | E D | | | | E 30-80% (viii) | |
| SOFOSBUVIR | | | 34% | | 6%D4% | | | 9%E6% | | 5%D27% | | | | 6% | | 6% | |
| Posible aumento de la exposición al antiviral Posible disminución de la exposición al antiviral No hay efecto significativo D. posible disminución de la exposición ARV E. posible aumento de la exposición ARV i Daclatasvir se debe reducir a 30 mg una vez al día con ATV/r o EVG/c. No se debe reducción de la dosis con ATV sin potenciar ii Daclatasvir debe aumentarse a 90 mg qd iv | | ||
| Sin interacción clínicamente significativa | |||
| No se deben co-administrar estos fármacos | |||
| | |||
| Posibles interacciones que se prevé que sean de baja intensidad (<2 AUC veces ó AUC <50%). No se recomienda ajuste de dosis a priori | |||
| | |||
| iii Usar sólo con ATV sin potenciar y en personas sin mutaciones significativas a IP (ATV aumenta la exposición a paritaprevir por inhibición de CYP3A4 e inhibición a OATP1B1/3, no se recomienda sin dasabuvir) iv La coadministración disminuyó la concentración mínima de Darunavir o Etanolato de Darunavir en aproximadamente un 50%. A pesar de que la administración conjunta de Darunavir o Etanolato de Darunavir con ombitasvir/paritaprevir/r + dasabuvir no se recomienda en la información de prescripción de Estados Unidos, la ficha técnica europea informa que Darunavir o Etanolato de Darunavir (en dosis de 800 mg qd y administrado al mismo tiempo que ombitasvir/paritaprevir/r + dasabuvir) se puede utilizar en ausencia de amplia resistencia a IP de VIH y se debe tomar sin RTV adicional. v Aumento de la exposición a paritaprevir cuando se coadministra con Darunavir o Etanolato de Darunavir 800 mg administrado con Viekirax vi Problemas de tolerabilidad graves vii No se recomienda a menos que el beneficio supere el riesgo debido al potencial de prolongación del intervalo QT con mayores concentraciones de rilpivirina, la coadministración sólo debe considerarse en personas sin prolongación del intervalo QT conocida y sin otras medicaciones concomitantes que prolonguen el intervalo QT viii Monitorización frecuente de la función renal debido al aumento de TDF si contenido en el régimen | |||
Hasta inicios de 1990 no existía un tratamiento para la infección por Hepatitis C. El primer tratamiento utilizado fue el interferón con porcentajes de respuesta menores al 10% y una miríada de efectos adversos. La adición de ribavirina a la terapia con interferón pegilado aumento considerablemente el porcentaje de RVS hasta un 30% a 40% en pacientes con genotipo 1, pero se acompañó de mayores efectos adversos y mayores porcentajes de abandono a la terapia. Estos resultados incentivaron la innovación de fármacos dirigidos contra blancos virales específicos (Antivirales de Acción Directa) los cuales fueron aprobados hasta 2011. Desde entonces la terapia triple con interferón, ribavirina y la primera generación de AAD se convirtió en el estándar de tratamiento, aunque con porcentajes de RVS bajos, de entre 65% a 75% con muchos efectos adversos y descontinuación de la terapia por desarrollo de anemia, fatiga, síntomas constitucionales e interacciones farmacológicas que resultaban en progresión de la enfermedad, descompensación hepática y aparición de hepatocarcinoma. Actualmente varios regímenes libres de interferón se encuentran disponibles, están compuestos por dos o tres ADD, con los cuales se ha observado, en ensayos clínicos, mayores tasas de RVS, con menor duración del tratamiento, menor número de efectos secundarios y de tabletas, así como mayor cobertura de genotipos y menos resistencias virales.
Tabla V-F: Esquemas de tratamiento por genotipo
| Esquema | Cirrosis | Esquema con base en genotipo | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | ||
| Sofosbuvir/ velpatasvir | No | 12 semanas | 12 semanas | 12 Semanas | 12 Semanas | 12 Semanas | 12 Semanas |
| Sí | 12 semanas | 12 Semanas | 12f Semanas | 12 Semanas | 12 Semanas | 12 Semanas | |
| Sofosbuvir/ ledipasvir | No | 12a Semanas | | | 12d Semanas | 12d Semanas | 12d Semanas |
| Sí | 12a Semanas | | | 12d Semanas | 12d Semanas | 12d Semanas | |
| Grazoprevir/ elbasvir | No | 12b Semanas | | | 12e Semanas | | |
| Sí | 12b Semanas | | | 12,d,e Semanas | | | |
| Ombitasvir/ paritaprevir/ritonavir/ dasabuvir (3D) | No | 12c Semanas | | | | | |
| Sí | | | | | | |
a No recomendado en genotipo 1a con experiencia a tratamiento
b En genotipo 1a sólo con carga viral menor de 800 mil UI/ml
c No recomendado en genotipo 1a
d No recomendado en pacientes con experiencia a tratamiento
e En carga viral menor de 800 mil UI/ml
f Con ribavirina
* Experiencia a tratamiento: pacientes tratados con peg-INF y ribavirina; peg-INF, ribavirina y sofosbuvir; sofosbuvir y ribavirina.
Adaptado del protocolo técnico del Seguro Popular actualizado en 2018. Se escogieron esquemas libres de interferón, en lo posible libres de ribavirina, con menor carga de tabletas, con duración de 12 semanas y sin necesidad de realizar análisis en busca de mutaciones asociadas a resistencia en NS5A o polimorfismos como Q80K, pero pueden utilizarse otros esquemas considerados en el protocolo técnico previa valoración por comité o especialista.
1. En pacientes con tratamiento antirretroviral con efavirenz, etravirina o nevirapina no se recomienda Sofosbuvir/ velpatasvir, 3D, Elbasvir/grazoprevir.
2. En pacientes con tratamiento antirretroviral con inhibidores de proteasa no se recomiendan esquemas 3D ni grazoprevir/elbasvir.
3. Pacientes en tratamiento con tenofovir y ledipasvir o velpatasvir, se debe vigilar estrechamente la función renal por un aumento esperado en las concentraciones de TDF ó TAF.
4. Pacientes con maraviroc potencial interacción importante con esquema 3D.
5. Pacientes con elvitegravir coformulado no se recomiendan con esquema 3D o Elbasvir/grazoprevir.
6. Se recomienda en todos los casos antes de iniciar terapia valorar posibles interacciones con: inhibidores de la bomba de protones, estatinas, anticonvulsivos, depresores del sistema nervioso central, antiarrítmicos, anticoagulantes, antiagregantes e inmunosupresores.
Coinfección VIH/VHB
Es común la coexistencia del VIH con otros virus causantes de hepatitis, como el VHC y el VHB, debido a que comparten formas de transmisión (vía sexual, parenteral y vertical). Dicha asociación acelera la evolución a cirrosis con incremento en la mortalidad en las personas que viven con VIH.
La hepatitis B (VHB) es a principal causa de enfermedad hepática crónica en todo el mundo. Existen, en el mundo, unos 400 millones de personas infectados por VHB, se estima que un 5% de toda la población mundial es portadora de VHB. A nivel mundial y en América del Norte el 10% de las PVVS tienen co-infección con VHB.
Existen diferentes estudios de seroprevalencia en población mexicana. En un estudio realizado en seis países de Latinoamérica, en México se encontró una seroprevalencia del 1.4% de anti-VHBc, en personas de uno a 40 años. Esta prevalencia es menor en los más jóvenes, aumentando de forma progresiva con la edad, de forma que en el grupo de 31 a 40 años alcanza un 3.3%, se encontró que el 0.1% tenían HBsAg, marcador que indica infección actual o crónica. Juárez-Figueroa y et. al, reportaron una prevalencia total de 1,9% de portadores cónicos de VHB, en 1,337 PVVS en la Ciudad de México, siendo más alta en HSH (4,8%) con una seroprevalencia del 15.4% de anti-VHBc.
Existe una clara asociación entre la transmisión de la infección por VIH y por el VHB. En personas monoinfectadas por VHB el 5 a 10 % de los adultos y el 90% de los niños infectados de manera vertical desarrollaran un a hepatitis crónica. Sin embargo, el VIH afecta la historia natural del VHB aumentando el riesgo de desarrollar hepatitis crónica (del 20%) y de cirrosis (4 veces más riesgo). La co-infección VIH y VHB se ha asociado además, a un mayor riesgo de reactivación cónica por VHB y a una eliminación más lenta del antígeno HBe (12%) comparado con los VIH negativos (49%) a los 5 años de seguimiento.
Tabla V-G. Efectos de la coinfección VIH/VHB
| VHBVIH | VIHVHB |
| Replicación del VIH Hepatotoxicidad del TARA CD4 en cirrosis por hiperesplenismo CD4 por activación inmunitaria si hay replicación VHB Progresión a cirrosis | Cronificación del VHB Replicación del VHB Seroconversión antiHBe y antiHBs Reactivaciones de la hepatitis Eficacia del tratamiento antiVHB · Respuesta al interferón · Frecuencia de las mutaciones de resistencia a antivirales |
Diagnóstico
En la actualidad, se recomienda realizar pruebas serológicas para descartar infección por VHB. La prueba inicial debe incluir pruebas serológicas para antígenos de superficie (HBsAg), anticuerpo contra el núcleo "core" de la hepatitis B (Anti-HBc total) y anticuerpos en contra del antígeno de superficie (anti-HBs).
Algoritmo V-A Algoritmo de diagnóstico de infección por VHB
Tratamiento de personas con coinfección VIH/VHB
Los objetivos del tratamiento en personas con co-infección VIH/VHB son prevenir la progresión de la enfermedad para reducir la morbilidad y mortalidad relacionada con el VHB. La supresión de la replicación viral de manera sostenida se asocia con normalización de la ATL y mejoría histológica. En los pacientes tratados con supresión de la replicación viral sostenida aumenta la supervivencia y disminuye el riesgo de desarrollo de cirrosis, hepatocarcinoma o necesidad de trasplante hepático.
Los análogos de nucleós(t)idos hasta ahora empleados para tratar la hepatitis B (tenofovir, entecavir, emtricitabina, lamivudina, adefovir, telbivudina) tienen también actividad frente al VIH, por lo que pueden desarrollar mutaciones de resistencias en el VIH si se utilizan en monoterapia. Por tanto, el tratamiento de la infección por VHB debe estar perfectamente coordinado con el de la infección por VIH. (Tabla V-H).
El tratamiento del VHB está indicada en pacientes con enfermedad hepática activa (ALT elevada, DNA-VHB > 2000 UI/ml o fibrosis significativa AI).
El TAR incluyendo agentes con actividad contra el VIH y VHB se recomienda para todos los pacientes con co-infección independientemente del recuento de CD4 (AII). El esquema en personas con infección VIH y VHB debe incluir al menos dos ARV activos contra VHB, preferentemente TDF/FTC o TAF/FTC, sin importar el nivel de DNA-VHB (AIII). Se debe evitar la administración crónica de lamivudina o emtricitabina como único medicamento activo contra el VHB debido a la alta tasa de selección de mutaciones de resistencia de VHB (AI).
El tratamiento alternativo para la infección activa para VHB en los pacientes que se niegan a iniciar TAR contra el VIH es PegINF a durante 48 semanas.
Tabla V-H. Fármacos aprobados para el tratamiento de infección por VHB
| Eficacia de los fármacos aprobados para el manejo de personas coinfectadas por VIH y VHB | ||||||||
| | PegINF a | Lamivudina | Adefovir | Tenofovir | Entecavir | Telbivudina | ||
| Dosis | 180µg/sem SC | 300mg/día VO | 10mg/día VO | 300mg/día VO | 0.5mg/día VO | 600mg/día VO | ||
| Hepatitis crónica | HBeAg (+) | INDICADO | INDICADO | INDICADO | INDICADO | INDICADO | INDICADO | |
| | HBe Ag (-) | | | | | | | |
| % de pacientes indetectables | HBeAg (+) | 14-19 | 36-44 | 13-21 | 68 | 68 | 77 | |
| | HBe Ag (-) | 63 | 60-73 | 51-64 | 93 | 90 | 88 | |
| % pérdida del HBsAg | | | | | | | ||
| | 1 año | HBeAg (+) | 3 | <1 | 0 | 3 | 2 | <1 |
| | | HBe Ag (-) | 4 | <1 | 0 | 0 | <1 | <1 |
| | 2 años | HBeAg (+) | NA | 3 | ND | 5 | 5 | ND |
| | | HBe Ag (-) | 8 | ND | 5 | ND | ND | ND |
| % de resistencias | | | | | | | ||
| 1 año | NO | 15-30% | No | 0 | No | 5 | ||
| > 1 año | NO | 70 a 5 años | No | No | <1 % | 22 | ||
| Mutaciones de resistencias | | L180M, M204V/I, V173L | N236T, A181S/T | A194T | M250V, T184G,S202I | | ||
| Duración del tratamiento | 48 SEMANAS | INDEFINIDO | INDEFINIDO | INDEFINIDO | INDEFINIDO | INDEFINIDO | ||
(Continúa en la Tercera Sección)
1 Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents. Department of Health and Human Services. Disponible en http://aidsinfo.nih.gov/contentfiles/lvguidelines/adultandadolescentgl.pdf